Sammanfattat
Behandling med cancerläkemedel har inneburit att vissa cancerformer kan botas nästan helt i dag (testikelcancer och cancer hos barn).
Under de senaste 20 åren har cancerläkemedel stått för en stor del av förbättringen i överlevnad i t ex bröst-, lung- och kolorektalcancer.
Kostnaderna för cancerläkemedel har ökat med 10–20 procent per år under de senaste tio åren och står i dag för knappt 10 procent av den totala läkemedelskostnaden i Sverige och för 15 procent av cancersjukvårdens totala kostnader.
Ökningstakten för cancerläkemedelskostnaderna kommer sannolikt att minska under de kommande fem åren på grund av generisk konkurrens för flera substanser (0–10 procent per år).
Ökningen i användning av cancerläkemedel i Sverige följer relativt väl den genomsnittliga ökningen i Europa, men med relativt stora regionala skillnader inom landet.
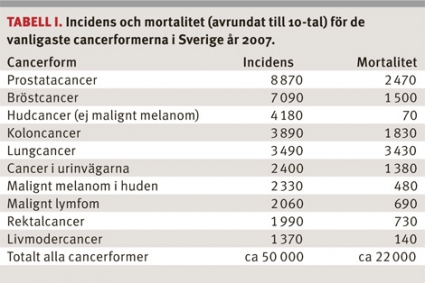
Cancer är en av de dominerande orsakerna till sjuklighet och död i Sverige. Varje år drabbas ca 50 000 individer av cancer, och ca 22 000 av dem avlider (Tabell I). Vi räknar med att varannan invånare drabbas av någon cancersjukdom under sin livstid.
Cancerbehandling och cancerläkemedel
Cancerbehandling i dag är multimodal, inkluderande kirurgi, strålbehandling och ett snabbt ökande antal läkemedel. Framgångarna har hittills varit relativt få när det gäller att förebygga cancer. Undantaget är restriktioner kring rökning. Förbättrade diagnostiska metoder och olika screeningprogram (t ex cervix- och bröstcancer) har möjliggjort tidig diagnos av ett flertal tumörsjukdomar, vilket också har förbättrat överlevnaden. Adjuvant behandling (tilläggsbehandling i botande syfte efter kirurgi) med cancerläkemedel och/eller strålbehandling används alltmer och har inneburit signifikant förbättrade behandlingsresultat för bröst-, kolorektal- och nu även lungcancer [1-5].
Cancerläkemedel introduceras vanligen vid metastatisk sjukdom. I många fall kommer effekt vid metastatisk sjukdom att avspeglas i klinisk nytta även för adjuvant behandling.
Många cancerläkemedel som används i dag är cellcykelspecifika och är i allmänhet uttalat celltoxiska, vilket ofta innebär besvärliga biverkningar, såsom svårt illamående och kräkningar, svårbehandlade infektioner och allvarliga leukopenier, trombocytopenier och anemier. Dessa svåra biverkningar har gjort att patienter inte alltid kunnat få den tänkta dosen. Introduktionen av läkemedel för stödjande behandling (supportive care) kom i slutet av 1980-talet och början av 1990-talet, och innebar betydande framsteg när det gällde att hantera biverkningar. Blockerare av 5-HT3 (serotoninreceptorer typ 3) samt steroider lindrar illamående, olika typer av bredspektrumantibiotika gör att infektioner kan förebyggas eller behandlas och tillväxtfaktorer som G-CSF (granulocytkolonistimulerande faktorer) ökar antalet vita blodkroppar. Kostnaderna för dessa läkemedel var betydande redan vid introduktionen (800–1 000 kronor/dag i dåtida penningvärde). Ändå används dessa läkemedel i stor utsträckning, eftersom man anser att de gör stor nytta för patienterna i form av ökad effekt och minskad morbiditet.
Nyttan av cancerläkemedel
Behandling med cancerläkemedel har inneburit att vissa cancerformer nästan helt kan botas (testikelcancer och cancer hos barn), och i många fall botas långt fler än tidigare (bröst- och kolorektalcancer, lymfom och leukemier). I dag ser det ut som om de stegvisa förbättringar vi ser i överlevnad i cancer delvis beror på ökad och förbättrad användning av befintliga cancerläkemedel. De stora förändringarna, mot en mer biologiskt orienterad behandling, har gjort att sjukdomar som tidigare inte ansågs vara behandlingsbara nu kan behandlas med relativt stor framgång. Under de senaste 20 åren är det, generellt sett, cancerläkemedel som stått för en stor del av förbättringen i överlevnad inom t ex bröst-, lung- och kolorektalcancer [1-5].
Många cancerläkemedel ges till små patientgrupper, och kostnaderna per behandlad patient blir höga, eftersom forsknings- och utvecklingskostnaderna är desamma som för läkemedel riktade till större patientgrupper. Vi kan också förvänta oss att den ökade kunskapen om biologin vid cancersjukdomar kommer att leda till att allt fler subgrupper identifieras och att specifika läkemedel utvecklas för dessa grupper. Detta innebär att ett flertal nya läkemedel kommer att registreras enligt principen för särläkemedel (orphan drugs). Med särläkemedel menas läkemedel som har en mycket begränsad patientpopulation (5/10 000 invånare).
Det finns en del problem kring utvecklingen och godkännandet av särläkemedel. Den prekliniska och kliniska dokumentationen är ofta bristfällig. Den europeiska registreringsmyndigheten, EMA (European Medicines Agency), har i flera fall gett villkorat godkännande, vilket betyder att dokumentationen ska kompletteras. De kliniska studierna är ofta små och använder ofta placebo som jämförelse, även om det finns etablerad behandling för den tänkta indikationen. Man använder ofta surrogatparametrar i studier (t ex effekt, toxicitet), och studietiden är ofta alldeles för kort för att kunna dra några verkliga slutsatser om påverkan på överlevnaden. Priserna blir ofta mycket höga, vilket leder till att läkemedlen inte säkert blir kostnadseffektiva. Det finns en omfattande diskussion om man verkligen ska ställa lägre krav på särläkemedel än på andra läkemedel.
Försäljning av cancerläkemedel
För att kunna studera hur många patienter som får behandling med ett visst läkemedel kan vi i dag använda försäljningsstatistik. Självfallet vore det önskvärt att kunna knyta denna statistik till individ och diagnos, men i dagsläget finns i Sverige denna möjlighet enbart för receptförskrivna läkemedel via Socialstyrelsens förskrivningsregister, och då enbart i forskningssyfte. Det pågår dock flera initiativ, nationellt och internationellt, för att upprätta register för att kunna följa användningen för enskild individ, kopplat till diagnos. Ambitionen är även att koppla vissa effekt- och toxicitetsdata till dessa register. I slutänden är det även önskvärt att koppla hälsoekonomiska analyser till denna typ av register.
Vi har studerat hur olika cancerläkemedel används i Sverige och i andra europeiska länder. Vi har valt att dela in läkemedlen enligt följande: »mogna« = de som introducerades 1998 eller tidigare och »nya« = de som introducerades efter 1998. När det gäller »mogna« läkemedel (av vilka ett stort antal är generiska i dag, eller snart blir det) föreligger oftast en omfattande klinisk dokumentation av risk och nytta. Många av dessa läkemedel är integrerade delar av dagens terapier. Det gäller även en del av de »nya« läkemedlen, men för många av dem som fått sitt godkännande under de senaste fem åren verkar det finnas relativt olika uppfattningar om risk–nyttaförhållandet.
Användningen ger en bild av hur man värderar och prioriterar de läkemedel som finns i dag. Denna värdering återspeglas i både medicinska och ekonomiska bedömningar. Variationer i användning finns inte bara mellan länder, utan också inom länder. I linje med detta redovisar vi data om både nationella och regionala skillnader inom Sverige.
När vi redovisar europeiska data anges försäljningen i euro, och i svenska jämförelser anges försäljningen i svenska kronor. När det gäller den europeiska jämförelsen har vi angett användningen i mg/100 000 invånare eller korrelerat användningen i mg/fall av sjukdom (incidens eller mortalitet) för enskilda läkemedel.
Försäljningsdata baseras på statistik från IMS Health (Intercontinental Marketing Services). För europeiska genomsnittsdata använder vi oss av ett samlat begrepp för 13 västeuropeiska länder, E13, som omfattar länderna Belgien, Danmark, Finland, Frankrike, Italien, Nederländerna, Norge, Storbritannien, Spanien, Sverige, Schweiz, Tyskland och Österrike. De epidemiologiska data som används kommer huvudsakligen från den senaste EUROCARE-4-rapporten [6]. För svenska data har vi använt senast tillgängliga uppgifter från det svenska cancerregistret.
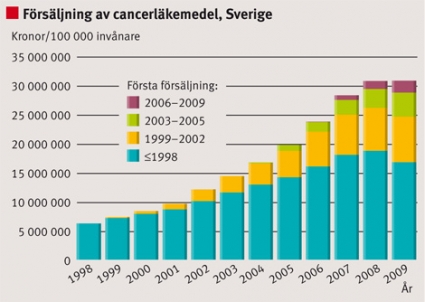
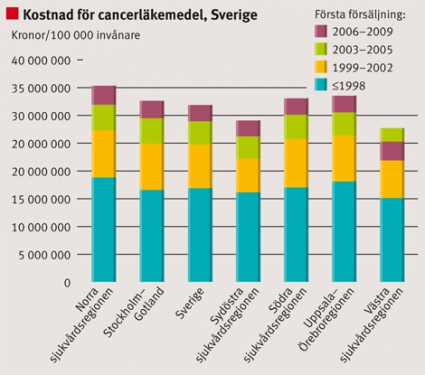
I Sverige ökade försäljningen av cancerläkemedel från ca 5 till 33 miljoner kronor/100 000 invånare under perioden 1998–2008. Försäljningsstegringen av de »mogna« cancerläkemedlen, från 4,3 till ca 18 euro per capita i Europa, står för huvudparten av den stora ökningen (Figur 1). Vad gäller försäljningen av cancerläkemedel i Sverige år 2008 stod »mogna« läkemedel för 55 procent, läkemedel introducerade 1999–2002 för 25 procent, introducerade 2003–2005 för 12 procent och introducerade 2006–2009 för 9 procent av den totala försäljningen. Ser vi till enskilda läkemedel kan vi notera att såväl »mogna« som »nya« läkemedel ökar betydligt i volym från registrering och fram till dess att de blir generiska. Det sker oftast en betydande volymtillväxt även efter det att läkemedlen blivit generiska.
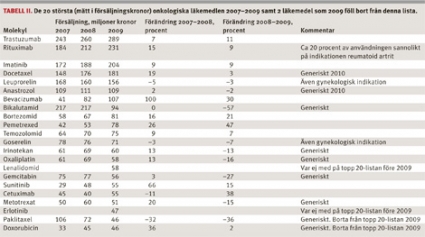
Generisk konkurrens kan medföra att kostnaden för ett läkemedel minskar med 70–80 procent. Totalkostnaderna för cancerläkemedel kommer troligen inte att öka; de kan till och med komma att minska inom vissa områden, eftersom patenten för ett stort antal »mogna« cancerläkemedel går ut inom de närmaste åren [7]. I Tabell II redovisas de 20 cancerläkemedlen med störst omsättning i Sverige 2009 och försäljningsutvecklingen 2007 och 2008.
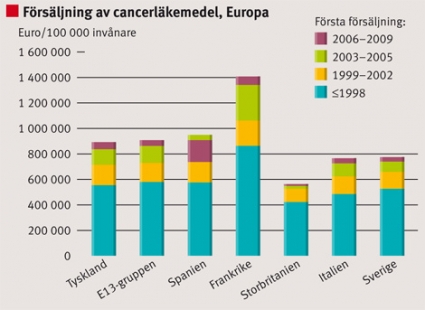
Det finns stora variationer mellan länder, både i hur snabbt ett cancerläkemedel accepteras och i hur stor försäljningen blir. Länder med lägre inkomst per capita har lägre tillgänglighet av nya cancerläkemedel, även om läkemedel i vissa av dessa länder står för en stor del av den totala sjukvårdsbudgeten. Frankrike och Spanien är de länder i Europa som snabbast tar nya cancerläkemedel i bruk. Särskilt uttalade variationer ses för nya läkemedel för behandling av kolorektal-, lung- och njurcancer.
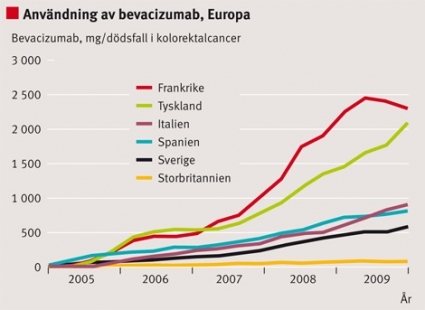
Utvecklingen i Sverige följer relativt väl den genomsnittliga utvecklingen i Europa, men varierar mellan olika läkemedel. Skillnaderna mellan Sverige och E13-gruppen visar på både relativt högre och lägre användning (t ex temozolomid högre och bevacizumab lägre). Ser man till sjukvårdsregionerna i Sverige föreligger också stora skillnader i användning av cancerläkemedel (Figur 1–3).
Läkemedelsanvändning inom specifika tumörområden
Bröstcancer. Av de solida tumörerna är bröstcancer den mest läkemedelsintensiva sjukdomsgruppen. Adjuvant behandling, med olika typer av cancerläkemedel efter kirurgi, har blivit standard i den multimodala hanteringen av sjukdomen. Den adjuvanta behandlingen har utvecklats över de senaste 30–40 åren, men det var inte förrän under 1980-talet som värdet av adjuvant behandling kunde visas. En viktig faktor i detta arbete var metaanalyserna som leddes av sir Richard Peto och EBCTCG (Early Breast Cancer Trialists’ Collaborative Group). Data från mer än 200 000 kvinnor har samlats in, och värdet av adjuvant behandling med kemoterapi och hormonell behandling har kunnat fastställas [1, 2].
Av alla bröstcancrar är 70–80 procent hormonellt beroende för sin tillväxt. Antiöstrogenet tamoxifen används i huvudsak för endokrin behandling av bröstcancer. Tamoxifen introducerades 1975, och ansågs först vara en dyr behandling med begränsad effekt. Dock har tamoxifen senare visats vara den mest kostnadseffektiva behandlingen för cancer över huvud taget. Den vida användningen för både avancerad sjukdom och adjuvant (i USA även som prevention) är det största genombrottet i den medicinska behandlingen av bröstcancer. Efter mer än 15 års uppföljning är värdet av tamoxifenbehandling bevisat. Dödligheten i hormonreceptorpositiv bröstcancer har minskat från 35 procent till 25 procent efter 15 års uppföljning [1].
Aromatashämmare (anastrazol, exemestan, letrozol) har delvis ersatt tamoxifen i vissa grupper av patienter (både som adjuvant behandling och vid avancerad sjukdom). Ännu har man visat endast begränsad överlevnadsfördel för aromatashämmare på 1–3 procent [8, 9] om aromatashämmare används enbart eller i sekvens med tamoxifen.
De första adjuvanta cytostatikabehandlingarna utvecklades också under 1970-talet, med kombinationer av alkylerare och antimetaboliter. Kombinationsregimen CMF (cyklofosfamid, metotrexat, 5-FU [5-fluorouracil]) gav 32 procents förbättrad relativ överlevnad jämfört med ingen behandling.
I andra generationens behandlingsstrategi byttes antimetaboliterna ut mot antracykliner (doxorubicin och epirubicin), och detta förbättrade överlevnaden ytterligare. Den tredje generationens adjuvant behandling med taxaner (docetaxel och paklitaxel) ger ytterligare 6 procents relativ ökad överlevnad [2].
Den tydliga minskning vi har sett i bröstcancerdödlighet sedan 1970-talet (totalt 25 procent och nästan 50 procent bland kvinnor under 70 år) är resultatet av utvecklingen av adjuvant behandling samt tidig diagnos via de screeningprogram som finns i de flesta länder i Europa [1, 2].
Den biologiska terapin, trastuzumab (HER2-receptorantikropp), som kom in i behandlingsarsenalen under 2000-talet, har dramatiskt påverkat överlevnaden för kvinnor med HER2-positiv bröstcancer (i Sverige ca 15 procent av alla nydiagnostiserade och 20–30 procent av alla kvinnor med metastatisk HER2-positiv sjukdom). Trastuzumab var först godkänt för metastatisk sjukdom baserat på starka kliniska data med 8–10 månaders förlängd överlevnad hos kvinnor med HER2-positiv bröstcancer, som behandlas i första linjen med trastuzumab och kemoterapi. Med adjuvant behandling har man visat en 50-procentig riskreduktion för återfall efter ett års tilläggsbehandling med trastuzumab [10, 11].
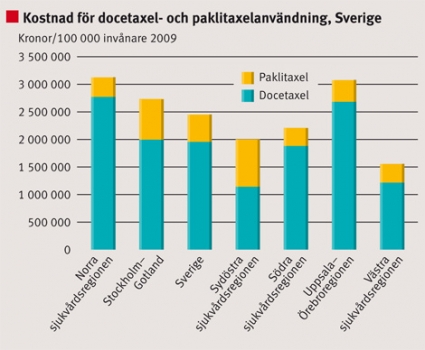
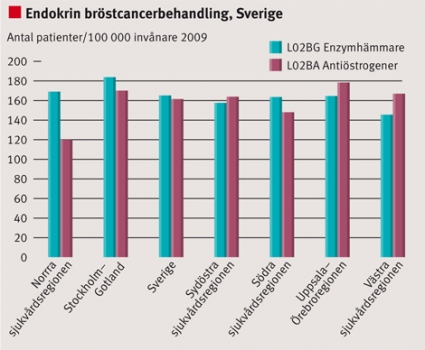
Användningen av cancerläkemedel för bröstcancer illustreras med användningen av taxaner, docetaxel och paklitaxel samt endokrin behandling (Figur 4 och 5). Av Figur 4 och 5 framgår att det föreligger relativt stora regionala skillnader mellan t ex de norra och sydöstra sjukvårdsregionerna.
Kolorektal cancer. Ända fram till slutet av 1980-talet ansågs medicinsk behandling av kolorektalcancer ha liten eller ingen effekt. Förbättrade överlevnadsdata berodde huvudsakligen på utvecklingen av diagnostiska och kirurgiska metoder. Efter publiceringen av data om adjuvant behandling med modulerat 5-FU under 1980- och 1990-talen blev kolorektal cancer ett område där intresset ökade för användning av läkemedel. Under 1990-talet visade irinotekan och oxaliplatin effekt som tillägg till 5-FU. Detta är fortfarande den gängse behandlingen för både tidig och avancerad kolorektal cancer [4].
Adjuvant 5-FU (finns nu också som oral behandling) i kombination med oxaliplatin har förbättrat överlevnaden för patienter i stadium III (spridning till lokala lymfkörtlar), medan värdet i stadium II (tumörväxt genom tarmens muskelvägg men utan spridning till lymfkörtlar) är osäkert; för patienter i stadium I (tumörväxt genom tarmväggen och utan spridning till lymfkörtlar) är kirurgi fortfarande den enda behandlingen.
Den senaste utvecklingen inom kolorektal cancer är identifieringen av en undergrupp av patienter med ett särskilt, icke-muterat (vildtyp) K-ras (genuttryck). Behandling med EGFR
(epidermal growth factor-receptor)-blockad har gett bättre effekt på tumörer hos patienter med vildtyp-K-ras. Det senaste EGFR-läkemedlet – panitumumab – är godkänt för patienter med just vildtyp-K-ras. Detta gäller nu också cetuximab, som sedan tidigare är godkänt vid behandling av metastatisk sjukdom. Vid metastaserande kolorektalcancer är 30–50 procent K-ras-muterade [12].
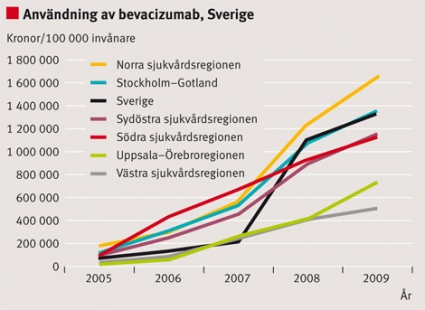
För kolorektal cancer visar vi försäljning av bevacizumab i Europa och Sverige (Figur 6 och 7).
Icke-småcellig lungcancer (NSCLC). Den vanligaste formen av lungcancer är icke-småcellig lungcancer (non-small cell lung cancer, NCSLC). Det har funnits en betydlig behandlingsnihilism när det gäller åtminstone avancerad NSCLC bland många läkare och i många länder. Fokus har legat på primär prevention (där Sverige ligger i Europatopp) och att identifiera patienter tidigt i sjukdomsförloppet, så de kan bli föremål för kurativt syftande kirurgi.
Det var först när data om effekterna av platinabaserad kemoterapi vid avancerad lungcancer kom i mitten av 1990-talet som trenden vände. Det blev då mer allmänt accepterat att behandla patienter med avancerad NSCLC. Detta var också starten för utvecklingen av ett antal nya läkemedel för patienter med NSCLC. Det finns i dag solida data även för adjuvant behandling [5]. Under 1990-talet kom nya cancerläkemedel, såsom taxaner, gemcitabin och vinorelbin, att användas i kombination med cisplatin eller karboplatin.
Under de senaste fem åren har ytterligare intressanta möjligheter med EGFR-blockerare tillkommit, såsom gefitinib och erlotinib, samt kemoterapi med pemetrexed. Effekten av gefitinib och erlotinib har kopplats till subgrupper av patienter med särskilda EGFR-mutationer [13]. Effekten av pemetrexed är också kopplad till specifika patologiska undergrupper av NSCLC, framför allt patienter med icke-skivepitelhistologi [14].
Efter att länge ha betraktat NSCLC som en sjukdom med hög dödlighet och utan möjlighet till medicinsk behandling kan man nu se en framtid med hopp om att både konventionell kemoterapi och de nya biologiska behandlingarna ska kunna erbjuda bot i större utsträckning.
Nationell bedömning kan mota regional skillnader
Läkemedel intar en central plats i den onkologiska behandlingen. Vår kunskap om cancerutveckling och biologin kring denna har ökat dramatiskt under de senaste decennierna. Denna ökade kunskap har lett till en utvecklingsvåg av cancerläkemedel, som kan jämföras med vad vi såg inom kardiologin under 1970–1980-talet, inom gastroenterologin under samma period och inom psykiatrin under 1980–1990-talet. Vi ser i dag en liknande utveckling inom reumatologin och de neurodegenerativa sjukdomsgrupperna. Cancerläkemedlen dominerar också forskning och utveckling inom läkemedelsindustrin.
Användning av cancerläkemedel har lett till ökad bot för flera stora tumörområden (bröst-, kolorektal- och nu även lungcancer) och har förlängt och förbättrat överlevnaden vid ett antal tumörformer. De förbättringar som vi sett när det gäller överlevnad kan tyckas relativt små och stegvisa. Men om vi ser 20–30 år tillbaka i tiden har det ändå skett markanta förbättringar. Screening av bröstcancer, förbättrad diagnostik och kirurgi vid kolorektal cancer samt antirökpolitiken har alla bidragit till att Sverige ligger väl till när det gäller de flesta cancerformer avseende sjukdomsbörda, men även avseende behandlingsresultat.
Kostnaderna för cancerläkemedel har ökat ungefär dubbelt så mycket som kostnaderna för cancersjukvård i övrigt (från 7–8 procent av de direkta sjukvårdskostnaderna för 10 år sedan till ungefär 15 procent av de direkta sjukvårdskostnaderna i dagsläget).
Kostnaderna är dock inte enbart beroende på användning av nya läkemedel, utan två tredjedelar av kostnaderna härrör sig till »mogna« läkemedel (läkemedel som funnits tillgängliga sedan före 1998).
Det föreligger stora variationer mellan europeiska länder med hög användning, t ex Frankrike och Spanien, och länder med låg användning, t ex länder i forna Östeuropa samt Storbritannien. Sverige ligger vanligen strax under medelnivån i Europa.
I Sverige föreligger relativt stora regionala skillnader, som tycks variera över tid. Vi noterar att de två regioner (västra sjukvårdsregionen och sydöstra sjukvårdsregionen) som var nummer 1 och 3 år 2000 när det gäller användning av cancerläkemedel nu är de två regioner som använder minst cancerläkemedel per invånare. Det är därför svårt att dra slutsatser om effekterna av olika användning, eftersom de överlevnadssiffror vi ser i dag snarast reflekterar cancerbehandlingen under perioden 1995–2000. Hög användning är ju inte heller lika med rätt användning, men hur rätt användning definieras är en komplex och delvis laddad fråga.
Självklart spelar de faktiska kostnaderna för cancerläkemedlen en central roll för hur användningen regionalt ser ut. Användningen av vissa specifika cancerläkemedel – både »nya« och »mogna« – varierar kraftigt mellan regionerna i Sverige, men det är svårt att få fram de reella orsakerna till denna variation. Den medicinska bedömningen skiftar, och de ekonomiska förutsättningarna är olika i Sveriges sjukvårdsregioner.
När det gäller många av de nya läkemedlen vore det av stort värde att ha en nationell bedömning, såväl medicinsk som hälsoekonomisk (en uppgift för Tandvårds- och läkemedelsförmånsverket, kanske även avseende sjukhusläkemedel). Bedömningen bör också samstämma med omvärlden (i alla fall med Europa).
*
Potentiella bindningar eller jävsförhållanden: Nils Wilking och Bengt Jönsson är konsulter vid i3 Innovus, som är ett s k contract research-företag inom framför allt hälsoekonomi och dotterbolag till United Health Group, ett av USA:s största sjukförsäkringsbolag. i3 Innovus arbetar med uppdrag från läkemedelsindustrin, olika myndigheter och branschorganisationer. Detta innebär att Nils Wilking och Bengt Jönsson anlitas som arvoderade föreläsare av de flesta företag verksamma inom området cancerläkemedel och av myndigheter, både nationellt och internationellt.