Sammanfattat
Cancersjukdomar står för en fjärdedel av den totala dödligheten i Sverige.
Av cancersjukdomarna står lung-, bröst och prostatacancer samt tjock- och ändtarmscancer för den största sjukdomsbördan (ca 50 procent), mätt i funktionsjusterade levnadsår, DALY.
Utvärdering av nytta i förhållande till kostnader är angeläget, men svårt, eftersom det är många faktorer som ska vägas samman.
Cancerläkemedel kan vara kostnadseffektiva vid introduktion, trots ett högt pris.
Kliniska studier kan undervärdera den totala nyttan av ett läkemedel i klinisk användning.
Tamoxifenbehandling vid bröstcancer ger hög avkastning i form av kvalitetsjusterade levnadsår, QALY (låg kostnad – hög effekt).
Imatinibbehandling vid kronisk myeloisk leukemi ger också hög avkastning (hög kostnad – hög effekt).
Hälsoekonomiska beräkningar kan bli svårare i framtiden, eftersom antalet läkemedel per indikation kommer att öka och antalet indikationer per läkemedel kommer att minska.
Cancer är den vanligaste dödsorsaken, näst efter hjärt–kärlsjukdomar. I Sverige inträffade över 50 000 nya cancerfall år 2006, och ca 20 000 avled i cancer.
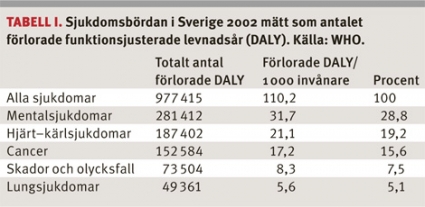
Cancersjukdomarna svarar för en fjärdedel av den totala dödligheten. Mätt som den totala sjukdomsbördan, som innefattar effekter på både mortalitet och morbiditet, är cancer den tredje största sjukdomen efter hjärnans sjukdomar och hjärt–kärlsjukdomar. I flera länder har cancer passerat hjärt–kärlsjukdomar, som minskat under senare decennier till följd av prevention och behandling (Tabell I).
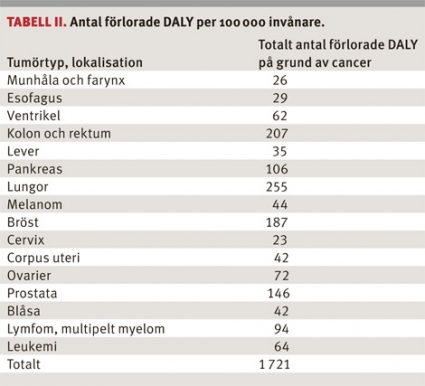
I Tabell II redovisas antalet förlorade funktionsjusterade levnadsår (disability-adjusted life years, DALY) per 100 000 invånare för tio olika cancertyper. Lungcancer, tjock- och ändtarmscancer, bröstcancer och prostatacancer har den största sjukdomsbördan (ca 50 procent): 795 förlorade DALY av totalt 1 721 förlorade DALY per 100 000 invånare.
Det finns ingen aktuell studie av cancersjukdomars kostnader i Sverige, men i en rapport från Cancerfonden [1] var de totala kostnaderna drygt 30 miljarder kronor år 2004, fördelat hälften vardera på direkta och indirekta kostnader. Läkemedelskostnaderna beräknades i rapporten till 2 miljarder, vilket inkluderar alla läkemedel för personer med cancer (1,4 miljarder för ATC-grupperna L01 och L02, som innefattar de allra flesta antitumorala läkemedel); cancerläkemedel svarade för cirka 6 procent av de totala läkemedelskostnaderna.
Exempel på kostnader för cancersjukvård
De direkta sjukvårdskostnaderna för cancer utgjorde 7 procent av de totala sjukvårdskostnaderna. Detta ligger väl i linje med internationella beräkningar: 6,6 procent i Tyskland, 5,6 procent inom National Health Service (NHS) i England och 5 procent i USA. Cancersjukdomarnas andel av sjukvårdskostnaderna är således mycket lägre än deras andel av dödligheten (25 procent) eller sjukdomsbördan (ca 15 procent).
Studier visar att slutenvårdskostnaderna dominerar för cancer, med ca två tredjedelar av de totala kostnaderna för cancervård. Detta trots att behandling av cancer allt oftare sker i öppenvård, såväl med läkemedel som med kirurgi och strålbehandling. Antalet vårddagar i sluten vård för cancer minskar, trots att fler patienter behandlas.
Lidgren, Wilking och Jönsson har beräknat de direkta och indirekta kostnaderna för bröstcancer i Sverige år 2002. De totala direkta och indirekta kostnaderna beräknades till 3 miljarder kronor för de personer som 2002 hade diagnosen bröstcancer, oberoende av när diagnosen hade ställts. Direkta kostnader beräknades till 895 miljoner (30 procent), medan indirekta kostnader var 2,1 miljarder kronor, lika fördelat mellan produktionsbortfall till följd av sjukdom och för tidig död [2].
Den stora sjukdomsbördan för bröstcancer i gruppen ekonomiskt aktiva kvinnor visar på de ekonomiska vinster som förebyggande insatser och bättre behandling kan innebära. Kostnaden för den slutna vården var ca 320 miljoner kronor, en tredjedel av de totala direkta sjukvårdskostnaderna.
I en studie från Uppsala beräknades kostnaden för behandling av metastaserande bröstcancer från diagnos till död. Medelkostnaden per behandlad patient var ca 900 000 kronor (131 000 amerikanska dollar), med en spridning mellan 700 000 kronor (99 000 dollar) och 1 200 000 kronor (168 000 dollar) beroende på vilken typ av behandling patienten fick. Studien omfattar relativt få patienter, men visar två viktiga aspekter. Den första är att behandlingskostnaden (per patient med en genomsnittlig överlevnad på 20 månader) nu uppgår till ca 1 miljon kronor per patient [3]. Läkemedelskostnaden utgör cirka en tredjedel av den totala kostnaden. Den andra aspekten är att kostnaderna varierar mellan olika subgrupper av patienter klassificerade efter hormonreceptor- och HER2-status.
Cancerläkemedel och ekonomi
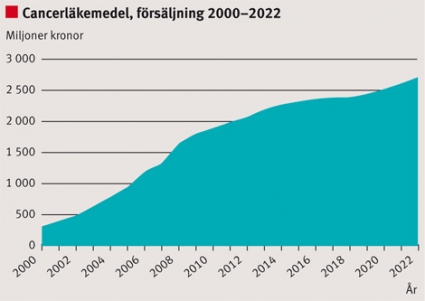
Kostnaderna för cancerläkemedel ökade mellan år 2000 och 2007 från 640 miljoner kronor till 2 450 miljoner i Sverige, en kostnadsökning på över 20 procent per år i genomsnitt. Ökningstakten efter 2007 har varit väsentligen lägre.
I ett tillägg till Cancerstrategiutredningen och på uppdrag av Läkemedelsindustriföreningen (LIF) tog vi, tillsammans med IMS Health, fram en prognosmodell för utvecklingen av kostnaderna för cancerläkemedel för de kommande 15 åren [4]. Basår för prognosen är 2007. Beräkningen bygger på ett urval av de viktigaste cancerläkemedlen och de största cancertyperna. Kostnaden räknas sedan upp till att omfatta alla läkemedel för respektive diagnos.
Framskrivningen bygger på tre faktorer: en uppskattning av antalet personer med cancer under de kommande 15 åren, andelen av dessa som behandlas med läkemedel och läkemedelskostnaden per patient. Figur 1 visar den prognostiserade utvecklingen av totalkostnaderna för Sverige.
Enligt modellen beräknas de totala kostnaderna för cancerläkemedel öka från 2,5 miljarder kronor år 2007 till 4,8 miljarder år 2022. Den prognostiserade kostnadsutvecklingen är väsentligt lägre än den vi sett under senare år med kostnadsökningar på 15–20 procent per år. En bidragande faktor till detta är att priserna inte förväntas öka, utan vi får i stället prissänkningar till följd av patentutgångar för flera läkemedel med stor användning.
Troligen sker samma utveckling inom cancerområdet som vi tidigare sett när nya läkemedel introducerats vid andra sjukdomar, t ex magsår, hyperlipidemi, multipel skleros och reumatoid artrit. I alla dessa fall startade man också från en mycket låg läkemedelskostnad, vilket ger stor procentuell kostnadsökning i början. I genomsnitt var den absoluta kostnadsökningen ca 250 miljoner per år under perioden 2000–2007, vilket i prognosen reduceras till ca 150 miljoner under de kommande åren, främst som en följd av beräknade prissänkningar på existerande läkemedel. Det är dock svårt att förutse utvecklingen, eftersom det är omöjligt att inkludera oväntade nya läkemedel eller nya indikationer på befintliga läkemedel.
Kostnaderna för läkemedel mot cancer har ökat i relation till andra kostnader, både inom cancersjukvården och i relation till kostnaderna för andra sjukdomar. Prevention (t ex vaccination mot humant papillomvirus [HPV]), tidig upptäckt och behandling liksom palliativ vård utvecklas och gör också anspråk på utökade resurser. Det är troligt att kostnaderna för cancervården kommer att öka både absolut och relativt under det kommande decenniet, vilket inte är orimligt sett i relation till sjukdomsbördan och till de höga indirekta kostnaderna, dvs resurser som samhället förlorar till följd av att personer som får cancer inte kan arbeta.
Kostnad och nytta av nya cancerläkemedel
Priserna och kostnaden per behandling med cancerläkemedel har ökat över tiden. Kombineras flera läkemedel kan kostnaden – i vissa fall – närma sig 1 miljon kronor per patient och år. Den relativa kostnaden jämfört med tidigare använda läkemedel framstår som hög, och naturligt nog ställs frågor om relationen mellan kostnad och nytta. Möjligheten att få tillgång till behandling är beroende av att den offentliga sjukvården betalar för läkemedlen. Kostnaderna måste vägas mot andra angelägna insatser inom sjukvården, t ex prevention för att minska antalet cancerfall eller förbättring av den palliativa vården.
Beslut rörande avvägning mellan kostnader och nytta i relation till andra angelägna behov tillhör de svåraste inom sjukvården. Olika metoder har utvecklats för att på ett objektivt sätt analysera dessa val, t ex systematiska jämförelser av effekt och biverkningar och kostnad–effektanalys. Dessa metoder kompletterar de utvärderingar som görs av registreringsmyndigheterna, EMA (European Medicines Agency) och Läkemedelsverket, som ligger till grund för tillståndet att sälja läkemedlen.
En redogörelse för nyttan börjar med en sammanställning av de medicinska effekterna. Ökad överlevnad är det viktigaste effektmåttet. Det finns också andra värden av nya läkemedel som vi är villiga att betala för, t ex mindre biverkningar och/eller bekvämare administrationsformer, som i sin tur kan leda till bättre livskvalitet och lägre kostnader. Men beräkningar av sjukdomsbördan visar att det är minskad risk för återfall efter diagnos (ökad andel botade patienter) som är mest angeläget, framför allt om vi vill minska antalet förlorade DALY.
De nya läkemedel mot cancer som passerat EMA:s utvärdering granskas sedan igen som underlag för beslut för att fördela ekonomiska resurser.
I Sverige fattar Tandvårds- och läkemedelsförmånsverket (TLV) beslut om läkemedlet ska ingå i läkemedelsförmånen. TLV har ännu prövat endast ett litet antal nya cancerläkemedel. Det beror dels på att TLV:s föregångare Läkemedelsförmånsnämnden (LFN) startade först i oktober 2002, dels på att man huvudsakligen prövar läkemedel som förskrivs inom läkemedelsförmånen. Sjukhusläkemedel, dvs de flesta cancerläkemedel, ingår för närvarande inte i TLV:s uppdrag.
SBU (Statens beredning för medicinsk utvärdering) granskar också nya cancerläkemedel med utgångspunkt i kostnader och nytta. SBU har som mål att göra sin värdering så tidigt som möjligt för att ge vägledning för beslutsfattare innan praxis fastlagts. Problemet är att det ofta saknas tillräcklig kunskap för att kunna avgöra den totala nyttan. SBU:s utvärderingar har därför fokuserats på etablerade metoder, där det redan finns omfattande evidens att granska och värdera, t ex strålbehandling och traditionella cytostatika.
Socialstyrelsen har även gjort hälsoekonomiska analyser, som ingår i riktlinjerna för cancerbehandling.
I England gör NICE (National Institute of Clinical Excellence; ‹http://www.nice.org.uk›) på uppdrag av NHS sådana utvärderingar. De har granskat bl a 52 nya cancerläkemedel/indikationer (NICE 27 oktober 2009). Det är intressant att konstatera att man endast i fem fall fann att läkemedlet inte hade tillräckligt dokumenterad effekt eller att kostnaderna inte stod i proportion till nyttan. Detta innebär inte nödvändigtvis att läkemedlen används i större utsträckning. NHS håller just nu på med en utredning för att undersöka detta [5].
Exempel på effekt/nytta av cancerläkemedel
Ett exempel på svårigheten att fastställa nyttan av cancerläkemedel i ett tidigt skede illustreras av diskussionen om värdet av vaccination mot HPV-infektion, vilket kan minska risken för livmoderhalscancer. Kostnaderna för behandling med nya cancerläkemedel kan också ses i relation till kostnaden för förebyggande insatser. De nya vaccinerna förebygger HPV-infektion, som är associerad till livmoderhalscancer. Kostnaden per vaccination är ca 3 000 kronor, vilket innebär att de flesta familjer kan betala för det själva, även om det för en del kan vara en betydande utgift.
Risken finns dock att många väljer att inte vaccinera sig, främst de med låga inkomster, vilket leder till ojämlikhet i hälsa om vaccinet är effektivt. Ett nationellt vaccinationsprogram för alla flickor har därför beslutats, till en kostnad av ca 200 miljoner kronor. Detta är troligen en underskattning, eftersom kostnader för uppföljning och kontroll och eventuella tilläggsdoser inte är inkluderade.
Denna kostnad kan sättas i relation till det hypotetiska scenariot att ett läkemedel för behandling av livmoderhalscancer med samma förväntade effekt utvecklades. I detta fall skulle behandlingen begränsas till de 450 kvinnor som varje år får livmoderhalscancer. Det pris för behandling som motsvarar vaccinationsprogrammet skulle vara 440 000 kronor.
Om vaccinerna och behandlingen minskar dödligheten från 150 fall per år till 50 (maximala antalet om vi antar att vaccinet/behandlingen förhindrar alla dödsfall där HPV-infektion är involverad), skulle kostnadseffektiviteten i båda fallen kunna bedömas som god. Genomsnittsåldern för sjukdomsdebut är 54 år och för död 68 år, vilket innebär en förlust av flera kvalitetsjusterade levnadsår, och en relativt rimlig kostnad per vunnet kvalitetsjusterat levnadsår.
Problemet är att vi i dag inte kan uppskatta minskningen av antalet dödsfall. En skillnad mellan prevention och behandling är att i det senare fallet kommer effekten omedelbart, medan det tar 20–30 år innan vi ser någon effekt av exempelvis ett vaccinationsprogram. TLV har i sina subventioneringsbeslut bedömt att kostnadseffektiviteten är rimlig för HPV-vaccination, medan SBU i sin rapport är mera tveksam och betonar osäkerheten om effekten. Frågan kompliceras också av om vi även ska beakta andra vaccinationsstrategier, t ex att också vaccinera pojkar [6]; dock har detta inte visat sig lönsamt.
Mycket talar för att de kliniska studierna med sina rigorösa protokoll undervärderar nyttan i klinisk användning, i alla fall av en del nya läkemedel [7]. Detta får naturligtvis ställas mot att det också kan förekomma felaktig användning, som inte ger de förväntade effekterna redovisade i de kliniska studierna. För att kunna belysa dessa frågor fordras utvärdering och uppföljning av användningen i klinisk praxis. Tyvärr är insamling av data i dag otillräcklig för att kunna genomföra sådana studier.
I en artikel publicerad under 2009 redovisas en beräkning av avkastningen på investeringarna i sjukvården i USA för perioden 1980–2000 [8]. Bröstcancer är ett område med hög avkastning, framhåller författarna, och speciellt tamoxifen för adjuvant behandling av bröstcancer. Avkastningen beräknas som antalet vunna kvalitetsjusterade levnadsår, som märks med ett bestämt pris, baserat på amerikanska studier av betalningsvilligheten. Den höga avkastningen av tamoxifenbehandling vid bröstcancer är resultatet av låg kostnad i kombination med bra effekt. Patentet för tamoxifen gick ut under perioden, och resultatet av kontrollerade studier har bekräftat effekten på överlevnaden. Det kan tilläggas att det inte var uppenbart på 1970-talet och början av 1980-talet att tamoxifen hade effekt på överlevnaden, och det debatterades då om huruvida läkemedlets höga kostnad var motiverad.
Imatinib och trastuzumab – två aktuella cancerläkemedel
Imatinib och trastuzumab är två läkemedel som introducerats under de senaste tio åren, och om vilka det förts en intensiv diskussion om kostnader och nytta [9]. De kan därför utgöra exempel på de problem som finns i att göra sådana bedömningar, men också på vilken kunskap sådana diskussioner har gett.
Imatinib vid KML/GIST. Imatinib visade en överlevnadsvinst i de tidiga kliniska studierna vid kronisk myeloisk leukemi (KML). Eftersom uppföljningstiden var begränsad, måste överlevnadsvinsten, dvs antalet vunna levnadsår per patient, uppskattas genom statistisk analys, och beräkningen blir förenad med stor osäkerhet. I en studie där imatinib jämfördes med behandling med interferon beräknades överlevnadstiden till 15,3 respektive 9 år, en överlevnadsvinst på drygt 6 år för dem som behandlades med imatinib [10].
Den årliga kostnaden för behandling med imatinib är ca 300 000 kronor, vilket indikerar en rimlig kostnadseffektivitet. Med tiden har beräkningarna kunnat preciseras; resultatet visar att överlevnadsvinsten liksom kostnaderna har underskattats i de tidigare beräkningarna. Antalet vunna levnadsår beräknas till 10,0 och antalet vunna QALY till 8,9, vilket ger en kostnad per QALY på ca 350 000 kronor (50 000 dollar) [7]. Den långa överlevnadstiden innebär att kostnaderna för sjukvården stiger, eftersom allt fler patienter erbjuds behandling.
Två nya läkemedel som komplement och substitut till imatinib har introducerats, dasatinib och nilotinib, vilket ytterligare kan förbättra behandlingsresultatet, men till en kraftigt ökad kostnad.
Imatinib har nu introducerats för en ny indikation, gastrointestinal stromacellstumör (GIST), vilket kräver nya beräkningar för att relatera kostnaderna till nyttan i form av överlevnad [11].
Detta exempel visar två saker. Den första är svårigheten att i ett tidigt skede beräkna nyttan på grund av både brist på data (kort uppföljningstid etc) och brist på underlag för att bedöma hur mycket större nyttan blir vid optimal användning i praktiken. Den andra är att uppföljningsstudier är viktiga för att verifiera tidigare antaganden och anpassa behandling till de nya kunskaperna.
Trastuzumab vid bröstcancer. Trastuzumab introducerades i Sverige år 2000 för behandling av metastatisk bröstcancer. År 2005 såldes trastuzumab för ca 92 miljoner kronor i Sverige, och 2009 uppgick försäljningen till 289 miljoner kronor. Kostnadseffektiviteten blir beroende av hur man identifierar patienter för behandling, eftersom nyttan av behandlingen beror på ökad förekomst av en specifik cellreceptor (HER2), som måste definieras innan behandling är aktuell.
Valet av optimal teststrategi blir en ekonomisk frågeställning i sig. De två test som används för att fastställa HER2-status, IHC (immunhistokemi) och FISH (fluorescent in situ-hybridisering), kostar ca 2 000 respektive 5 000 kronor. Eftersom behandlingskostnaden med trastuzumab uppgår till ca 250 000 kronor för ett års behandling, medför möjligheten att identifiera de 15–25 procent av patienterna som kan ha nytta av behandlingen en stor ekonomisk besparing.
Möjligheten att kunna identifiera vilka som har nytta av en behandling är således alltid en tillgång, men hur ett sådant test ska användas på ett optimalt sätt måste bedömas från fall till fall och beror på bl a kostnaderna för testet. Val av teststrategi blir en del av den större frågan [12]: Hur optimerar behandlingen resultatet med avseende på kostnader och effekt?
I en svensk studie har kostnadseffektiviteten för trastuzumab vid behandling av metastaserande bröstcancer beräknats till 485 000 kronor per vunnet kvalitetsjusterat levnadsår med en FISH-baserad teststrategi. Det är en relativt hög kvot, men den ligger inom vad som normalt skulle accepteras som en kostnadseffektiv behandling [13]. Den variation som finns i resultatet från olika internationella studier beror främst på olika definitioner av studerade test- och behandlingsstrategier.
En utveckling mot mer »individualiserad behandling« kommer att ytterligare öka komplexiteten i utvärderingarna, eftersom antalet behandlingsstrategier kommer att öka. Varje indikation måste studeras separat avseende nytta och kostnad, eftersom det innebär en ny behandlingsstrategi.
Behandling med trastuzumab vid tidig bröstcancer (adjuvant behandling) måste därför studeras separat. Detta får dessutom konsekvenser för nyttan och kostnaden för behandling av metastaserande sjukdom, eftersom patienten redan behandlats en gång tidigare. Adjuvant behandling innebär också att många fler patienter kommer att behandlas, vilket ökar belastningen på sjukvårdens budget. Det är därför vanligt att adjuvant behandling utsätts för mer noggrann ekonomisk analys. Dock är det inte bara kostnaderna som ökar. De potentiella vinsterna ökar också om behandlingen fungerar.
Kostnadseffektiviteten för adjuvant trastuzumabbehandling har för Sverige beräknats till 335 000 kronor (36 000 euro) per vunnet kvalitetsjusterat levnadsår (QALY). Kostnadseffektiviteten är således bättre för adjuvant behandling än för behandling av metastaserad sjukdom. Detta är inget ovanligt resultat och innebär att bedömningen av pris i relation till nytta för behandling av metastaserande sjukdom underskattar nyttan för potentiellt botande behandling [14].
Det är också viktigt att se till kostnadseffektiviteten på längre sikt. Trastuzumab, liksom tamoxifen, kommer troligen att vara ett värdefullt läkemedel långt efter det att patentet gått ut. Antar vi att patentutgången halverar priset, kommer också kostnadseffektiviteten att fördubblas. Värdet för samhället av läkemedlet ökar således, medan värdet för företaget som utvecklat läkemedlet minskar.
Prostatacancer – ökat antal patienter driver kostnadsökning
Kostnaderna för prostatacancer i Sverige har beräknats i ett antal studier. Sennfält et al beräknade de direkta sjukvårdskostnaderna för 204 svenska män med diagnosen prostatacancer som avled 1996–1997, oavsett dödsorsak. Den totala kostnaden per patient var oförändrad mellan 1984 och 1998, med ett genomsnitt på 150 000 kronor i konstanta priser. Sammansättningen av kostnaderna varierade dock över tiden, där läkemedelsandelen ökade från 7 till 17 procent genom mer utbredd användning av LHRH(luteinizing hormone-releasing hormone)-analoger under perioden. Slutenvården stod annars för den största kostnadsandelen. Ökningen av de totala sjukvårdskostnaderna till följd av prostatacancer berodde helt och hållet på ökningen av antalet fall – 55 procent – under perioden 1995–1998 [15].
För prostatacancer förväntas också antalet patienter öka, dock inte lika mycket som för bröstcancer. Läkemedelskostnaden per behandlad patient förväntas minska från ca 16 000 till 11 000 kronor, som en följd av patentutgång för några av de vanligast använda läkemedlen. Nettoeffekten blir en moderat kostnadsökning, som helt drivs av det ökande antalet patienter. Detta stämmer väl överens med den tidigare utvecklingen för prostatacancer. Det har varit ett ökat antal fall, inte en ökning av kostnaderna per behandlad patient, som varit drivande för kostnadsutvecklingen.
Prostatacancer har låga indirekta kostnader, eftersom större andelen patienter är äldre och flertalet som får diagnosen har slutat arbeta. Sjukdomen har också vanligen ett långsamt förlopp, vilket innebär att konsekvenserna ytterligare förskjuts upp i åldrarna, där ofta andra sjukdomar orsakar mer sjukvårdskonsumtion och död. För yngre män är dock de indirekta kostnaderna dominerande, vilket inte får glömmas bort när vi värderar potentiellt kurerande behandlingar i denna åldersgrupp.
Sjukdomens effekt på livskvalitet kan ses som en kostnad. Sennfält uppskattade att en total eliminering av smärta hos en prostatacancerpatient skulle ge ett tillskott på 0,85 QALY per patient under hela sjukdomsförloppet. Ett läkemedel som kunde åstadkomma detta skulle ha ett värde på ca 500 000 kronor per patient, om vi tillämpar den sedvanliga värderingen på 600 000 kronor av ett kvalitetsjusterat levnadsår [16].
Lungcancer – läkemedelsbehandling får allt större plats
Ett område där läkemedelsbehandlingen förväntas få större plats är lungcancer. Detta är en stor patientgrupp där behandling med kirurgi, strålbehandling och läkemedel hittills inte på långa vägar lett till samma överlevnadssiffror som vid bröst- och kolorektalcancer. Det finns dock anledning att tro att det även vid lungcancer kommer att ske betydande framsteg, och då framför allt när det gäller läkemedel.
Lungcancer, som vi kartlagt i en nyligen genomförd studie [17], svarar för ca 15 procent av den totala sjukdomsbördan för cancer, men bara 8 procent av de direkta sjukvårdskostnaderna. De indirekta kostnaderna dominerar stort med 87 procent av de totala kostnaderna, främst till följd av för tidig död. Ser vi på de direkta kostnaderna dominerar slutenvården med nästan 90 procent. Läkemedelsandelen beräknades, i den svenska delen av en internationell studie, till ca 1 procent. Detta är säkert en underskattning av dagens kostnader, eftersom antalet behandlade patienter ökat kraftigt mellan åren 2000 och 2007, med en kostnadsökning till 140 miljoner. Den totala kostnaden för läkemedel är dock fortfarande låg, räknat som andel av sjukvårdskostnaderna.
Hälsoekonomiska analyser för att finna bästa behandling
Den utveckling vi i dag ser inom onkologin, med kraftigt ökade läkemedelskostnader och bättre behandlingsresultat, har vi sett under tidigare decennier inom hjärt–kärlområdet, inom gastroenterologin med H2-receptorantagonister och protonpumpshämmare och inom reumatologin med tillkomsten av biologiska läkemedel. Detta visar att ökad kunskap om biologin vid en sjukdom eller en sjukdomsgrupp genererar ett stort antal nya läkemedel. Detta ger nya möjligheter, men också ökade kostnader på kort och medellång sikt. För att vara förberedd och kunna hantera de fortsatta möjligheterna och kostnadsutvecklingen inom onkologin är det viktigt att utveckla databaser och metoder för hälsoekonomiska analyser.
Vi konstaterar att det inte finns någon heltäckande redovisning av behandlingen av cancersjukdomar eller av cancervårdens kostnader, som kan ligga till grund för hälsoekonomiska bedömningar. Vi vet dock att de indirekta kostnaderna för produktionsbortfall för många cancersjukdomar, t ex bröst- och lungcancer, är väsentligt högre än de direkta sjukvårdskostnaderna. Vi vet också att de direkta sjukvårdskostnaderna för cancer är väsentligt lägre än cancersjukdomarnas andel av mortalitet och sjukdomsbörda. Vi kan också konstatera att läkemedelskostnaderna ökat snabbare inom cancerområdet än inom andra områden. Tyvärr är det inte bara läkemedelskostnaderna som ökar, utan även antalet som insjuknar i cancer.
Det finns inte tillräckligt med information om kostnaderna för cancerläkemedel. Vår kunskap om nya cancerläkemedel är mycket begränsad när de först börjar användas. Optimalt utnyttjande av nya läkemedel innebär att finna behandlingsstrategier som är anpassade för den enskilde patienten. För att kunna göra dessa val krävs uppföljningsstudier och utveckling av modeller för att simulera nyttan av och kostnaderna för de olika alternativen. Men det innebär också att hälsoekonomiska överväganden måste göras redan i utvecklingsprocessen av nya läkemedel, så att resurser för forskning och utveckling inriktas på de områden där det finns störst potentiell nytta.
Nya läkemedel kan, framför allt på längre sikt, öka kostnadseffektiviteten och minska samhällets totala kostnader för cancer. Men på kort sikt är det viktigt att uppmärksamma att nya, effektiva och kostsamma läkemedel kräver god kompetens för att användas på bästa sätt.
*
Potentiella bindningar eller jävsförhållanden: Se artikeln »Användning av cancerläkemedel i Sverige och Europa« i temat.