Sammanfattat
Skelettet omsätts ständigt – bryts ned av osteoklaster och byggs upp igen av osteoblaster.
Osteoporos beror på obalans i remodelleringen så att mer ben resorberas än vad som byggs upp.
Detta leder till minskad mängd benvävnad och en förändring i den tredimensionella strukturen så att risken för benbrott ökar – skelettet blir skört.
Idag finns läkemedel som dels kan bromsa nedbrytningshastigheten, dels stimulera bennybildning. Dessa har visat sig leda till färre frakturer.
Huvuddragen i benvävnadens reglering har under de senaste åren kartlagts, och nu utvecklas läkemedel för att minska nedbrytningshastigheten eller till och med återskapa ben [1].
Benvävnaden omvandlas ständigt genom
modellering, i vilken benets storlek och grövre morfologi ändras
remodellering – en process som svarar för omsättning av skelett och frisättning av kalcium och fosfat.
Det är just remodelleringen av moget ben som är involverad vid uppkomst av benskörhet.
Benvävnadens sammansättning
Benvävnaden bildas av osteoblaster, mesenkymala celler som närmast är relaterade till dentin- och cementbildande celler i tanden men också till fibroblaster i huden. Ben bildas initialt genom att osteoblaster syntetiserar typ I-kollagena fibrer med identisk uppbyggnad som hudens och slemhinnornas kollagen. Benmatrixen består till 90 procent av kollagen och det är sammansättningen av de resterande proteinerna som gör benet unikt [2]; som exempel kan nämnas att osteokalcin och bensialoprotein är unika för skelettet. Osteoblasterna bildar också stora mängder av tillväxtfaktorer såsom transforming growth factor-β (TGF-β) och insulinliknande tillväxtfaktorer (IGF-I, -II) vilka inkorporeras i den mineraliserade benvävnaden och sedan används som signalmolekyler vid remodelleringsprocessen.
Vissa osteoblaster bildar det kompakta benet och en del innesluts under benbildningen i detta och övergår till så kallade osteocyter, som med hjälp av en mängd cellutlöpare inne i benvävnaden bildar ett nätverk med cellutlöpare från osteoblaster. Osteocyternas cellutlöpare misstänks härbärgera mekanoreceptorer som kan känna av belastning på skelettet och överföra detta till osteoblasterna, som då ökar benbildningen i området.
Osteoklaster bryter ned ben
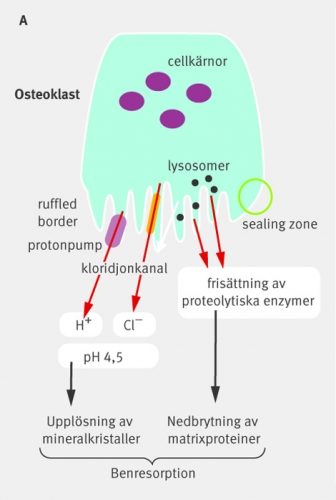
Hos en frisk vuxen individ omsätts 10 procent av skelettet varje år – mer i trabekulärt än i kompakt ben – vilket är förklaringen till att metabola bensjukdomar som postmenopausal osteoporos framför allt drabbar ben med relativt stor proportion trabekulärt ben som till exempel kotor och underarmsben [3]. Processen startar med att osteoklaster bryter ned det mineraliserade benet med mekanismer som initialt inbegriper upplösning av mineralkristallerna och som sedan följs av enzymatisk nedbrytning av proteinerna i benmatrixen (Figur 1A) [4]. Observera alltså att bennedbrytning alltid omfattar såväl urkalkning som matrixnedbrytning och att det inte finns något sätt att in vivo enbart urkalka skelettet. Demineraliseringen sker genom surgörning som möjliggörs genom att osteoklaster har både en protonpump och en kloridjonkanal i den del av cellen som kallas »ruffled border« och som bildas genom veckning av cellmembranet i resorptionslakunen. Matrixnedbrytningen är en följd av frisättning av proteolytiska enzymer in i resorptionslakunen. Dessa enzymer är ofullständigt kända även om vi vet att katepsin K har en betydelsefull roll. När den flerkärniga osteoklasten resorberar ben adhererar den till ben med en sugkoppsliknande mekanism som kallas »sealing zone« (adhesionzon). Molekylärt medieras adhesionen av en bindning mellan vitronektinreceptorer i osteoklastens cellmembran och osteopontin, som är ett av de många icke-kollagena proteinerna i benmatrixen. Hur en osteoklast vet vilken del av skelettet som behöver remodelleras är helt okänt, liksom också hur cellen vet när processen skall avslutas. Det är också okänt vilka molekylära förändringar som har skett i en benvävnad som behöver remodelleras, men det brukar förklaras med »materialtrötthet«.
Osteoklaster är ett slags vit blodkropp
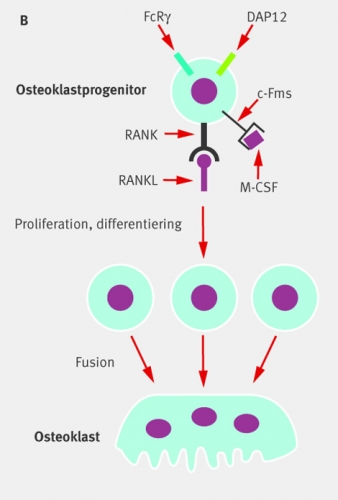
Mångkärniga, jättestora osteoklaster, som är de enda celler som kan bryta ned ben, bildas genom sammanslagning av flera enkärniga hematopoetiska prekursorceller, som antingen kan utvecklas till osteoklast, makrofag eller dendritisk cell [5, 6]. Idag vet vi att osteoklasten är en leukocyt. Styrningen av prekursorcellernas tillväxt och överlevnad beror på aktivering av receptorn c-Fms med cytokinen macrophage colony-stimulating factor (M-CSF). Den specifika differentieringen till osteoklast kräver aktivering av receptorn RANK (receptor activator of NF-kB) med den TNF (tumor necrosis factor)-relaterade cytokinen RANKL, samt aktivering av immunglobulinliknande receptorer kopplade till de membranbundna signalproteinerna DAP12 och FcRγ (Figur 1B). Vilka ligander som aktiverar det senare systemet vet vi ännu inte men de utgörs sannolikt av ligander bildade av både osteoklaster och osteoblaster. Aktivering av de tre komponenterna c-Fms, RANK och DAP12/FcRγ leder till aktivering av intracellulära signalsystem som transkriptionsfaktorena NF-kB och NFAT2, av vilka den senare betraktas som »huvudregulator« av osteoklastbildningen. Detta leder sedan till uttryck av en mängd gener som behövs för progenitorcellernas differentiering till osteoklaster och för dessa cellers funktioner som till exempel protonpump, kloridjonkanal, katepsin K och kalcitoninreceptor. Till stor del sker detta i hematopoetisk vävnad, men i ett visst skede frisätts osteoklastprogenitorceller, i likhet med övriga hematopoetiska celler, till cirkulationen där de återfinns i monocytfraktionen. Med en homingprocess som är okänd utträder cellerna ur kärl i benhinnor och uppträder nu som enkärniga osteoklastprogenitorer i benhinnor (periost). Här kan de slutgiltigt aktiveras så att de sammansmälter till flerkärniga, benresorberande osteoklaster. Osteoklaster finns således endast på benytor och i Haverska osteonsystem i kompakt ben. Det faktum att skelett bryts ned både under fysiologiska och patologiska betingelser av en cell som är mycket nära besläktad med immunkompetenta celler och att den aktiveras av molekyler som initialt upptäckts i immunsystemet, såsom RANK, immunglobulinliknande receptorer, DAP12 och FcRγ, har lett till utvecklandet av osteoimmunologi som en speciell nisch inom benbiologin [7].
Stromaceller och osteoblaster styr
I benmärgen finns inte bara hematopoetiska celler utan också så kallade stromaceller, multipotenta celler som kan utvecklas till bland annat fettceller, broskceller eller osteoblaster. Om stromaceller aktiveras av benresorptionsstimulerande hormoner som paratyreoideahormon (PTH) och 1,25(OH)2-vitamin D3 (vitamin D3) uttrycker de molekyler som M-CSF och RANKL [4-6]. Via direktkontakt mellan stromaceller och de progenitorceller som kan utvecklas till osteoklaster, makrofager eller dendritiska celler aktiveras progenitorcellerna längs den osteoklastiska linjen med hjälp av M-CSF och RANKL. När osteoklastprogenitorceller slutgiltigt aktiveras till flerkärniga osteoklaster i periost eller endost är det osteoblaster på benytan, aktiverade med PTH eller vitamin D3, som etablerar direktkontakt med progenitorcellerna och sedan terminalt differentierar dessa till osteoklaster med hjälp av RANKL, M-CSF och aktivering av DAP12/FcRγ.
Det är således inte osteoklastprogenitorceller som uttrycker receptorer för resorptionsstimulerande hormoner utan mesenkymala osteoblaster och stromaceller, vilket var mycket oväntat och svårt att förstå när det upptäcktes. Osteoblasten bestämmer således hur mycket ben som ska bildas och den reglerar också bildandet av osteoklaster och därmed benresorptionsaktiviteten. Det är förklaringen till att PTH under vissa betingelser (långvarigt höga nivåer) leder till ökad benresorption och under andra (intermittent förhöjda nivåer) till ökad benbildning. Det är inte bara PTH och vitamin D3 som reglerar benresorption via stromaceller och osteoblaster utan detta gäller även för benresorptionsstimulerande cytokiner som interleukin-1 (IL-1) och TNF liksom för kininer och prostaglandiner.
Remodellering – ett reglerat samspel
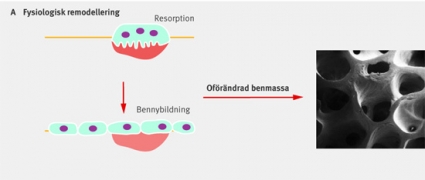
När osteoklasterna har avslutat resorptionen uppträder osteoblaster i resorptionslakunen [1]. Under normala fysiologiska betingelser bildas lika mycket nytt ben som osteoklasterna resorberat och vi behåller mängden benmassa oförändrad (Figur 2A). Hos en frisk individ har man beräknat att remodellering pågår på 1–2 miljoner enstaka ombyggnadsställen i de 220 ben som utgör skelettet. Nedbrytningsprocessen tar 3 till 4 veckor medan den efterföljande nybildningen tar 2 till 4 månader. Hur kopplingen mellan resorption och benbildning molekylärt regleras är inte känt, men frisättning av osteoblaststimulerande signalmolekyler som TGF-β och IGF från benmatrix spelar förmodligen en viktig roll.
Remodellering vid postmenopausal osteoporos
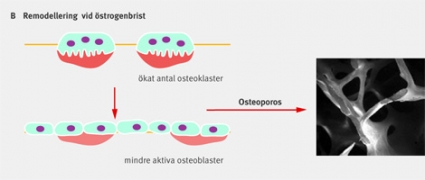
Postmenopausal osteoporos definieras som förlust av benmassa omfattande mer än 2,5 standarddeviationer jämfört med unga kvinnor i samma population. Tillsammans med en förändrad arkitektur av bentrabeklerna leder den minskade benmassan till ökad risk för fragilitetsfraktur [8, 9]. Risk för minskad benmassa är särskilt hög för kvinnor i samband med och efter menopaus. Efter 65-årsåldern är risken för minskad benmassa lika stor hos män och kvinnor och drabbar då både trabekulärt och kortikalt ben. Den snabbt insättande postmenopausala benförlusten beror på minskande östrogennivåer och kan också uppträda hos kvinnor som premenopausalt drabbas av minskande östrogennivåer. Den postmenopausala benförlusten beror på att antalet remodelleringsställen drastiskt har ökat och att osteoblaster inte förmår att fylla ut resorptionslakunerna helt och hållet (Figur 2). Dessa förändringar beror på minskade östrogennivåer vilket dels leder till ökad bildning av osteoklaster och dels till minskad stimulans av osteoblasternas benbildande förmåga. Av dessa anses den ökade resorptionen vara mest betydelsefull.
Att resorptionsaktiviteten ökar vid minskad östrogeninsöndring anses till stor del bero på minskad aktivering av de östrogenreceptorer som finns i osteoklaster och osteoblaster [10, 11].
Förutom den accelererade benförlusten vid östrogenbortfall sker det hos både män och kvinnor en successiv minskning av bentätheten under det naturliga åldrandet. Denna åldersbetingade benförlust beror dels på ökad resorption, men orsakas även av att den kopplade benbildningen efter resorptionsfasen avtar med stigande ålder. Utöver hypogonadismen anses en negativ kalciumbalans med minskade nivåer av vitamin D och mild sekundär hyperparatyreoidism leda till ökad resorption. Vad som orsakar den avtagande osteoblastaktiviteten är inte känt. Det kan röra sig om minskade mängder tillväxtfaktorer i benmatrixen, alternativt mindre mängd mesenkymala prekursorer med förmåga att utdifferentiera till mogna osteoblaster. Den primära osteoporosens patogenes kan därför sammanfattas som så att östrogenbortfallet vid menopaus leder till en abrupt ökad resorption. Med tiden leder en negativ kalciumbalans till en ännu mera uttalad resorption. Konsekvensen av detta förvärras av att åldrandet leder till att skelettets förmåga att svara upp med ny benbildning efter resorption försämras. Benmassan minskar successivt, trabekler försvinner och hållfastheten minskar drastiskt.
Verkningsmekanismer för skelettspecifika farmaka
Med kunskap om de cellbiologiska processer som styr skelettomsättningen har ett antal olika läkemedel framställts med
sikte på att minska förlusten av benvävnad vid remodellering, samt att eventuellt kunna bygga upp nytt ben [12]. Flera av dessa läkemedel har även genomgått stora fas III-studier i vilka de klart visat sig ha förmåga att inte bara öka bentätheten utan även reducera risken för frakturer. Idag har vi fem olika typer av skelettspecifika läkemedel inregistrerade som alla visat sig minska frakturrisken (Tabell I).
Bisfosfonater
Bisfosfonater, derivat av naturligt förekommande pyrofosfater, har en struktur i vilken två organiska fosfatgrupper är förenade via syre i stället för kol. Detta gör strukturen stabil. De skiljer sig endast i hur den centrala sidokedjan är utformad, vilket påverkar absorptionsmöjligheten samt hur potenta de är med avseende på osteoklasthämning.
Bisfosfonater binder till skelettmatrixen [13] och tas upp av aktiva osteoklaster, påverkar deras metabolism och orsakar apoptos. De tidigaste bisfosfonaterna bildar sannolikt toxiska ATP-metaboliter inne i osteoklasternas cytoplasma medan de senare, mera potenta aminoinnehållande bisfosfonaterna troligen utövar sin effekt genom att hindra steg i kolesterolmetabolismen.
Samtliga bisfosfonater har förmåga att inhibera osteoklastaktiviteten. Deras nytta vid osteoporosbehanling är därför att de bromsar den resorptiva fasen i remodelleringen. De kan inte bygga upp skelett, bara bevara benmassa. Inte desto mindre har bisfosfonater klart visat sig minska antalet nya frakturer i högriskgrupper.
Östrogener blev östrogenliknande SERM
Östrogenbortfallet efter menopaus leder till hastig benförlust, och östrogensubstitution var länge standardbehandlingen. Randomiserade studier visar att hormonbehandling efter menopaus bevarar benmassan och leder till färre frakturer. Eftersom långtidsbehandling med östrogener efter klimakteriet för närvarande är omdiskuterat på grund av biverkningsrisken har användandet av östrogen för att förebygga osteoporos i princip upphört. I stället har det skett en unik läkemedelsutveckling inom detta område och det finns idag ett antal preparat med förmåga att selektivt utöva östrogenliknande effekter i olika målorgan, så kallade selective estrogen receptor modulators (SERM). Dessa substanser testas på olika målorgan såsom skelett, bröstkörtel, endometrium och hjärta–kärl. För närvarande finns det ett sådant läkemedel på marknaden, raloxifen, med dokumenterat frakturförebyggande effekt i kota [14].
PTH
Det var oerhört förvånande när det visades att bisköldkörtelhormon (PTH) kunde stimulera bencellerna att bilda nytt ben, eftersom förhöjda PTH-nivåer vid hyperparatyreoidism anses vara en del av patogenesen för sekundär osteoporos vid dessa sjukdomstillstånd. Om man injicerar intakt PTH eller aminoterminala fragment (minst aminosyrorna 1–34) intermittent, till exempel som en daglig injektion, leder detta till en markant ökad benformation endostealt och trabekulärt och minskat antal frakturer [15]. Det är inte bara osteoblaster i befintliga remodelleringscykler som stimuleras utan uppenbarligen även osteoblaster på ytor som inte har varit utsatta för osteoklastaktivitet.
En konstant förhöjd nivå av cirkulerande PTH leder till att osteoblaster uttrycker RANKL på sina ytor och detta leder till ökad osteoklastaktivitet. Om man i stället administrerar PTH pulsatilt leder det till att samma målcell, osteoblasten, i stället för att befrämja resorption blir anabol och producerar nytt ben. Samma målcell, samma receptor och samma ligand, men diametralt motsatta svar beroende på hur cellerna ser sitt hormon. Det pågår nu en intensiv jakt på de exakta mekanismerna för att gå vidare i utveckling av potenta anabola osteoporosläkemedel.
Strontium
Senast i raden av läkemedel med förmåga att minska risken för fragilitetsfrakturer är strontium, som har förmåga att binda till hydroxiapatit som substitut för kalciumjonen. Nyligen har två välgjorda läkemedelsprövningar visat att strontiumbehandling leder till färre frakturer [16]. Strontium kanske utövar två olika effekter i skelettet; dels en antiresorptiv och dels eventuellt en anabol effekt. Svårigheten med strontiumstudier är att bentäthetsmätningarna blir falskt förhöjda. Teorin om en kombinerad effekt utgår från data med biokemiska markörer där man dels ser en minskning av resorptionsmarkörerna under behandlingen, vilket signalerar en hämmad osteoklasteffekt, men även en ökad mängd formationsmarkörer.
Kalcium och vitamin D3
Kalcium och vitamin D3 har alltid varit en hörnsten inom osteoporosbehandlingen. Under 1990-talet gjordes ett antal randomiserade prövningar som visade på klar frakturreduktion med kalcium- och vitamin D-behandling. Tydligast är detta visat hos äldre postmenopausala kvinnor. Det har diskuterats huruvida mekanismen är en sänkning av PTH-nivåerna, och därmed minskad resorption, eller om D-vitamintillskott leder till bättre muskelstyrka och balans och därmed färre fallolyckor. Emellertid har det under de senaste två åren publicerats ett antal studier som inte lyckats reproducera den förmodade frakturförebyggande effekten vid behandling med kalcium och vitamin D3. Studierna är förvisso kraftigt kritiserade för sina upplägg och bortfall men det måste idag anses tvivelaktigt att behandla osteoporospatienter med enbart kalcium och vitamin D3. Viktigt är dock att notera att kalcium och vitamin D alltid bör ges i kombination när man behandlar med andra skelettspecifika farmaka. Detta gäller både bisfosfonater, SERM, PTH och strontium. Den egentliga orsaken till detta är att samtliga läkemedelsstudier som ligger till grund för inregistrering av osteoporosläkemedel är gjorda med extra tillskott av kalcium och vitamin D, det vill säga mot en positiv kalciumbalans och i avsaknad av förmodad vitamin D-brist.
*
Potentiella bindningar eller jävsförhållanden: Östen Ljunggren bedriver utöver grundtjänsten konsultverksamhet i egen firma. Uppdragen innefattar föreläsningar, internetutbildning, rådgivning och prövningar för följande företag: AstraZeneca AB, Merck Sharp &Dohme AB, Eli Lilly Sweden AB, Aventis Farma AB, Nycomed AB, Leo, Roche AB, Amgen AB, Novartis AB. Inga aktier eller tillgångar ägs i något av ovanstående företag.
*
Potentiella bindningar eller jävsförhållanden, Ulf Lerner: Inga uppgivna.