Sammanfattat
Perkutan kateterburen aortaklaffimplantation (TAVI) är en ny metod för behandling av aortastenos som används i Sverige sedan 2008.
Tät aortastenos förekommer hos 3 procent av den äldre befolkningen och har hög mortalitet, som endast kan sänkas med aortaklaffbyte.
Många patienter bedöms ha för hög risk för kirurgi, och där ger TAVI en tydlig mortalitetsvinst och minskade symtom jämfört med medicinsk behandling.
För patienter som bedöms operabla men som har hög risk ger TAVI och kirurgiskt aortaklaffbyte en jämförbar mortalitet på ett års sikt.
Pågående studier som jämför kirurgiskt aortaklaffbyte med TAVI kommer att klargöra vilka patienter med aortastenos som är lämpliga för perkutan åtgärd.
Symtomgivande aortaklaffstenos är en vanlig sjukdom i den äldre delen av befolkningen och förekommer hos ca 3 procent av dem i ålder 65–74 år och hos 4 procent av dem >75 år [1]. Eftersom medellivslängden och därmed antalet äldre ökar förväntas vi få dubbelt så många patienter med tät aortastenos år 2025. Aortastenosen är ofta asymtomatisk under lång tid, sedan uppkommer smygande besvär i form av dyspné, eventuellt angina pectoris och synkope. Tvåårsmortaliteten är nästan 50 procent hos obehandlade symtomatiska patienter [2, 3].
Förkalkning av aortaklaffen leder gradvis till en flödesbegränsande stenos. En maximal flödeshastighet på 4 m/s genom aortaklaffen eller en medeltryckgradient på 40 mm Hg eller en beräknad klaffarea på under 1 cm2 brukar definieras som en tät aortastenos. Den vanligaste etiologin är åldersrelaterad förkalkning av en aortaklaff med från början normal trikuspid aortaklaff. Orsakerna är inte helt klarlagda, och det finns ingen medicinsk behandling som kan stoppa förkalkningsprogressen. Statinbehandling har prövats i en studie utan framgång [4].
Kirurgiskt aortaklaffbyte
Sedan Hufnagel 1952 implanterade den första klaffen i aorta descendens för behandling av aortainsufficiens [5] har symtomgivande aortastenos behandlats med öppen hjärtkirurgi, varvid klaffen excideras och ersätts med en mekanisk eller biologisk klaffprotes (SAVR, surgical aortic valve replacement), som är en klass I-rekommendation enligt rådande riktlinjer i Europa och USA [6]. Kirurgiskt byte av aortaklaffen minskar symtomen och ökar överlevnaden, och om det inte finns allvarlig komorbiditet är den operativa mortaliteten låg (1,8–5 procent vid isolerat klaffbyte och 3,2–10 procent vid klaff- och bypass-operation [7, 8]). Det har visats att efter ett framgångsrikt kirurgiskt aortaklaffbyte sänks mortaliteten till samma nivå som hos en jämnårig kontrollpopulation [9]. Minst 30 procent av patienterna med symtomgivande aortastenos genomgår dock inte klaffbyte av olika orsaker, som hög ålder, nedsatt vänsterkammarfunktion, multipel komorbiditet eller att patienten tackar nej till operation [10, 11].
Komorbiditet är dels faktorer som ingår i de mest använda riskbedömningssystemen (Euroscore och STS-score, som båda försöker predicera 30-dagarsmortaliteten), dels andra faktorer som uttalade förkalkningar i aorta ascendens, s k porslinsaorta, genomgången strålbehandling av bröstkorgen och bröstkorgsdeformiteter som kan ha betydelse för komplikationsrisken efter SAVR [12]. Det finns därför behov av en mindre invasiv åtgärd av aortastenos.
Perkutan aortaklaffimplantation
Perkutan aortaklaffimplantation (TAVI, transcatheter aortic valve implantation) är en ny behandling där en biologisk klaffprotes sätts inuti den nativa sjuka klaffen med kateterburen teknik. Henning Ruud Andersen i Danmark utvecklade metoden 1989, men det dröjde till 2002 innan Alain Cribier i Frankrike implanterade den första kateterburna (Edwards Sapien THV) aortaklaffen [13]. I Sverige utförs TAVI sedan 2008 och finns nu på nästan alla sjukhus med toraxkirurgi. Principen är att öppningen i den förkalkade klaffen vidgas med ballongdilatation, och därefter utvidgas en stent, som innehåller en biologisk klaffprotes, på den nativa aortaklaffens plats. Det finns nu två CE-märkta system (CoreValve, Medtronic, och Sapien, Edwards Lifesciences) i kliniskt bruk.
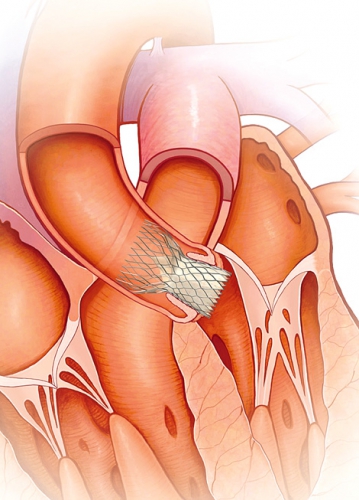
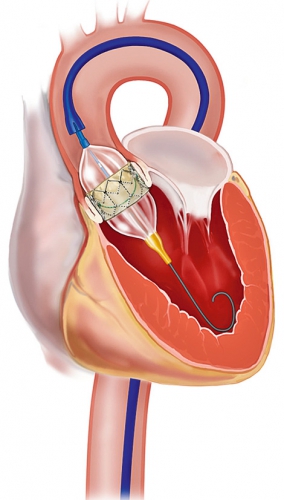
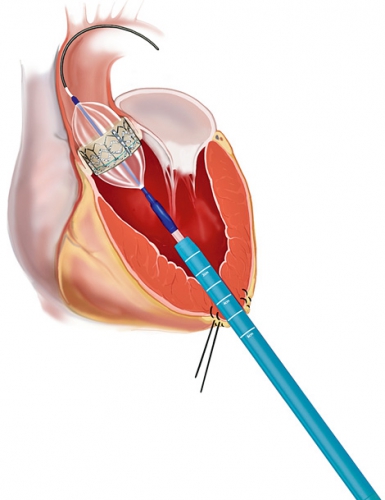
I dag har mer än 20 000 patienter behandlats med TAVI. Klaffimplantation med CoreValve kan utföras helt perkutant och utan intubationsnarkos via a femoralis eller a subclavia (Figur 1). Sapien-klaffen läggs transfemoralt med eller utan intubationsnarkos (Figur 2) eller med intubationsnarkos via en minitorakotomi genom apex cordis, dvs transapikalt till vänster kammare (Figur 3).
I de flesta fall utförs TAVI på koronarangiografilaboratorium, och klaffplaceringen sker under röntgengenomlysning med eller utan samtidigt transesofagealt eko. Klaffarna är stentbaserade, biologiska, tillverkade av gris- eller kalvperikard och uppbyggda av tre klaffblad, liknande de biologiska klaffar som implanteras med kirurgisk teknik. Leveranssystemet för den transfemorala tekniken har i dag en diameter på 18–19 F, dvs ca 6 mm.
Insättningen av klaffprotesen föregås alltid av en ballongvalvuloplastik under samtidig snabb stimulering av hjärtat med en temporär pacemaker med en frekvens på 180–220 per minut (s k rapid pacing), vilket medför att hjärtat i praktiken står stilla, och patienten är kortvarigt trycklös. Genom ballongvalvuloplastiken blir aortaostiet tillräckligt stort för att medge placering av stentklaffen. Insättningen av Sapien-klaffen sker under rapid pacing, medan insättningen av CoreValve sker under normal rytm. Vid insättningen är det av vikt att klaffen inte obstruerar kranskärlen, att den inte hamnar för långt ner i vänsterkammaren så att mitralisklaffen och septum påverkas samt att klaffen är så stor att paravalvulärt läckage undviks. Hela proceduren tar 1–3 timmar. I samband med ingreppet får patienten heparin och behandlas därefter livslångt med acetylsalicylsyra och oftast några månader med klopidogrel.
Ofta är verksamheten ett samarbete mellan kardiologer, toraxkirurger, radiologer och anestesiologer. Innan man kan påbörja en TAVI-verksamhet måste hela teamet ha genomgått en noggrann utbildning, som ofta inkluderar simulatorundervisning och besök på andra sjukhus. De första procedurerna utförs under översyn av en erfaren operatör. Detta förfarande har varit framgångsrikt och minskat de procedurrelaterade komplikationerna i sådan grad att någon inlärningskurva inte har kunnat påvisas i Sourceregistret [14].
Indikationer för TAVI
I dag finns det två patientpopulationer som potentiellt kan komma ifråga för TAVI: dels de som redan nu behandlas med TAVI på grund av excessivt förhöjd operativ risk (ofta definierad som >20 procent Euroscore eller >10 STS-score eller andra skäl, t ex porslinsaorta), dels de som har ökad kirurgisk risk men som ändå vanligen anses operabla.
Otvivelaktigt finns det många patienter som inte opereras för sin aortastenos; exempelvis utförs bara ett fåtal kirurgiska klaffingrepp per år i Sverige på patienter över 90 år. Att skatta den kirurgiska risken vid aortaklaffkirurgi är svårt, och de vanligen använda instrumenten för riskbedömning, Euroscore och STS-score, ger tyvärr ingen tillförlitlig bedömning av 30-dagarsmortaliteten hos patienter med aortastenos. Således är ordet »inoperabel« ett relativt begrepp. Dessutom är det ofta svårt att bedöma den symtomatiska vinsten av ett aortaklaffingrepp hos äldre. Aortastenos orsakar dyspné, men många patienter har också lungsjukdom, nedsatt vänsterkammarfunktion eller förmaksflimmer, som kan ge samma symtom. Allmänt nedsatt kondition kan orsakas av aortastenos men också av en mängd andra tillstånd.
TAVI bättre än medicinsk behandling
Sedan den första delen av PARTNER-studien publicerades i oktober 2010 finns det stark evidens (20 procent absolut mortalitetsvinst på ett år) för att använda TAVI på patienter med tät symtomatisk aortastenos som inte anses lämpliga för kirurgi [15]. I denna studie inkluderades 358 patienter med tät aortastenos där två kirurger bedömde att kirurgiskt aortaklaffbyte innebar för hög risk. Medelåldern var 83 år, 42 procent var tidigare opererade med koronar bypass och 23 procent hade KOL med syrgasbehandling. Patienter med koronarstenos och behov av revaskularisering exkluderades.
Patienterna randomiserades 1:1 till TAVI med Edwards Sapien THV-klaffen via a femoralis eller till optimal medicinsk behandling. I den medicinska behandlingen ingick möjlighet till ballongvalvuloplastik av aortaklaffen, vilket utfördes hos 84 procent och med relativt få komplikationer. Ballongvalvuloplastik av aortaklaffstenos utförs annars sällan på vuxna, eftersom det är känt att aortaklaffen tätnar igen inom några månader till ett år. Metoden har dock fått en renässans och kan användas som bro till TAVI eller kirurgiskt aortaklaffbyte [16].
Mortaliteten efter ett år (primärt effektmått) var 31 procent i TAVI-gruppen jämfört med 51 procent med optimal medicinsk behandling (P < 0,001; relativ riskreduktion 45 procent). På 30 dagars sikt fanns det vissa risker med TAVI jämfört med medicinsk behandling: möjligen högre mortalitet (5,0 mot 2,8 procent; P = 0,48), tendens till fler stroke (5,0 mot 1,1 procent; P = 0,06) och fler större blödningar (17 mot 4 procent; P < 0,001).
Hjärtsviktssymtomen, mätt som NYHA-klass, förbättrades i TAVI-gruppen, likaså livskvaliteten. 75 procent av de överlevande patienterna i TAVI-gruppen hade ingen eller lindrig dyspné vid ett års uppföljning jämfört med 42 procent i gruppen med medicinsk behandling. Gångsträckan vid sex minuters gångtest förbättrades efter TAVI men inte efter medicinsk behandling.
Den absoluta mortalitetsreduktionen på 20 procent är ett mycket tydligt fynd, som visar både hög dödlighet vid obehandlad symtomgivande aortastenos och att perkutan implantation av aortaklaffproteser är möjlig även hos mycket sjuka och gamla patienter.Vem är för gammal för TAVI?
Man kan fråga sig vem som är för sjuk och för gammal för att komma i fråga för TAVI, som är en dyr och avancerad behandling. Någon exakt gräns går inte att dra, men vår inställning är att ålder ensam inte är en begränsande faktor och att alla patienter som har möjlighet till ett någorlunda aktivt liv i ett par år kan komma i fråga för behandlingen. Patienterna måste också vara beredda att acceptera de risker som finns med ingreppet (stroke, kärlkomplikationer).
Det kan vara värt att veta att den återstående medellivslängden i Sverige är avsevärd långt upp i åldrarna (4,5 år för en 90-årig kvinna och 3,1 år för en 95-årig man, enligt 2009 års statistik).TAVI jämfört med kirurgiskt aortaklaffbyte
Nästa del av PARTNER-studien har nyligen presenterats [17]. Här randomiserades 699 patienter som bedömts som en högriskgrupp men operabla mellan TAVI (transfemoral eller, om detta inte var lämpligt, transapikal access) och SAVR. Medelåldern var 84 år, Euroscore var i genomsnitt 29 procent och 43 procent hade tidigare genomgått koronar bypass-operation.
Porslinsaorta, skador av toraxbestrålning eller bröstkorgsdeformitet var mindre vanliga bland dessa patienter än bland de »inoperabla« i den tidigare delen av PARTNER-studien (TAVI jämfört med medicinsk behandling). För övrigt var riskfaktorprofilen mycket lika. Det tål att nämnas att bara enstaka patienter per år i Sverige genomgår klaffkirurgi vid Euroscore över 20 procent [8]. Således skulle de flesta av studiens patienter aldrig ha accepterats för aortaklaffkirurgi i Sverige. Det primära effektmåttet var totalmortalitet, vilken inte skilde sig mellan grupperna efter ett år (24 procent efter TAVI jämfört med 27 procent efter SAVR). Efter 30 dagar var totalmortaliteten 3,4 procent efter TAVI och 6,5 procent efter SAVR, ingen signifikant skillnad. Uppenbarligen sköttes bägge grupperna väl, eftersom mortalitetssiffrorna hamnade en bit under de förväntade, trots en kraftigt förhöjd operationsrisk.
Förekomsten av stroke eller TIA inom 30 dagar var högre efter TAVI (5,5 procent) än efter SAVR (2,4 procent). Prestationen på 6-minuters gångtest var bättre 30 dagar efter TAVI än efter SAVR, vilket sedan utjämnades till 6 och 12 månader. Detta kan ses som ett tecken på kortare konvalescens efter TAVI. Paravalvulärt läckage av minst måttlig grad förekom i drygt 10 procent av fallen efter TAVI men knappast alls efter SAVR. Betydelsen på sikt av detta är ännu oklar.TAVI hos yngre patienter
Flera andra stora randomiserade studier som jämför TAVI och aortaklaffkirurgi har redan startat eller kommer att göra så inom en snar framtid; t ex planeras en nordisk studie där patienter ≥75 år randomiseras till TAVI eller SAVR. Detta är alltså en patientgrupp med betydligt lägre operationsrisk än vad PARTNER-studiens patienter hade. Det återstår där att se i vilken mån komplikationer som t ex stroke och blödningar minskar efter TAVI jämfört med hos sjukare patienter. Strategier för att minimera strokerisken behöver förbättras, och produkter för detta är under utveckling.
En förutsättning för att TAVI ska kunna användas hos yngre patienter är att klaffprotesens hållbarhet är lika god som den hos en kirurgisk biologisk aortaklaffprotes. Hittills finns dock inga indikationer på att detta skulle vara ett problem, och TAVI-proteserna har en liknande uppbyggnad som existerande biologiska klaffproteser.
Vi har också påbörjat ett svenskt TAVI-klaffregister med stöd från Socialstyrelsen och Svenska hjärtförbundet sedan november 2010. Registret ligger under Swedeheart-registret, där årliga rapporter kommer att publiceras.Konklusion
Således är TAVI en ny teknik för aortaklaffimplantation, som förhoppningsvis kan öka andelen patienter med aortastenos som får aortaklaffprotes. TAVI är bättre än medicinsk behandling och har jämförbara resultat som SAVR hos patienter med mycket hög operationsrisk. Framtida studier kommer att visa för vilka patienter TAVI respektive SAVR lämpar sig bäst.
*
Potentiella bindningar eller jävsförhållanden: Jan Harnek har arbetat som konsult för Edwards Lifesciences. Göran K Olivecrona arbetar som konsult för Edwards Lifesciences.Andreas Rück har erhållit föreläsningsarvoden och resebidrag från Medtronic, Edwards Lifesciences och St Jude.