Sammanfattat
De flesta prostatacancrar diagnostiseras i dag med histopatologisk undersökning av mellannålsbiopsier.
Patologens uppgift är att ställa diagnos och rapportera prognostiska faktorer.
Den viktigaste vävnadsbaserade prognosfaktorn är tumörgrad enligt Gleason. Vidare ska antalet biopsier med cancer och den linjära tumörutbredningen rapporteras. I enstaka fall kan man bedöma tumörstadium på biopsier.
I prostatektomipreparat bedöms även patologiskt tumörstadium och radikalitet.
Gleasongraderingen och stadiebedömningen har nyligen genomgått en genomgripande revision som får konsekvenser för den kliniska handläggningen.
Den i dag vanligaste metoden för diagnostik av prostatacancer är histopatologisk undersökning av mellannålsbiopsier tagna med transrektal ultraljudsvägledning. Syftet är att både fastställa diagnos och predicera sjukdomsförlopp i händelse av cancer. Morfologisk undersökning är ett krav för prostatacancerdiagnos eftersom övriga undersökningsmetoder har alltför låg specificitet för cancerdiagnostik. Palpabla förändringar i prostata kan förekomma vid granulomatös prostatit och prostatakonkrement, och det är vanligt att prostata är asymmetriskt förstorad vid prostatahyperplasi. Förhöjt serum-PSA är vanligt vid godartade former av prostataförstoring, såsom prostatahyperplasi och prostatiter. Undantagsvis ses kliniska fynd som i princip är patognomona för prostatacancer i form av tresiffrigt serum-PSA, radiologiskt påvisade skelettmetastaser och en klinisk symtombild som starkt talar för prostatacancer. I regel brukar man dock även i dessa fall vilja ha en morfologisk verifiering av cancerdiagnosen innan man inleder behandling.
I Sverige diagnostiserades prostatacancer förr ofta genom finnålspunktion, där provet togs med palpationsvägledning. Man erhöll ett cytologiskt utstrykspreparat och baserade diagnosen på cellatypi och celldissociation. Denna metod förekom knappast utanför Skandinavien och har på senare år minskat kraftigt även i Sverige. Orsaker till detta är att metoden är starkt användarberoende, har viss risk för falskt positiva diagnoser, har oacceptabelt hög andel oklara diagnoser samt att modern Gleasongradering och immunhistokemisk utredning inte kan utföras.
Biopsitagning
Det har blivit allt vanligare att det som föranleder biopsitagningen är förekomsten av förhöjt serum-PSA. En palpabel förändring vid rektalpalpation föreligger endast i en mindre del av fallen. Biopsering sker därför i huvudsak enligt ett systematiskt standardiserat schema som syftar till att täcka in olika delar av prostata. Systematisk mellannålsbiopsering utfördes ursprungligen ofta enligt ett s k sextantschema, men antalet biopsier har gradvis ökat, och vanlig standard i dag är 8–12 biopsier enligt ett på förhand fastlagt protokoll. Ytterligare biopsier kan eventuellt riktas mot förändringar som observeras vid ultraljudsundersökningen.
I Sverige tas dessa biopsier i huvudsak av läkare med specialistkompetens i urologi, men det förekommer även att radiologer utför biopseringen. Enligt en enkät som nyligen genomfördes bland 137 svenska urologer använde 86 procent numera alltid lokalanestesi vid mellannålsbiopsering [opubl data], vilket visats ge signifikant smärtlindring. Alla som besvarade enkäten använde något antibiotikum som profylax, vanligen ciprofloxacin (83 procent) med trimemtoprim–sulfametoxaxol på andra plats (15 procent).
Biopsierna ska läggas i separata behållare med formalin [1]. Det finns många skäl till att biopsierna inte får läggas i samma kärl. Det är avgörande både för urologens planering av behandlingen och för patologens tolkning av biopsierna att man vet var i prostata de tagits. Hantering av flera biopsier i samma kärl leder till fragmentering och därmed förlust av viktig information om bl a antal biopsilokaler med cancer och tumörutbredning. Separathantering av biopsier är förmodligen den enskilda åtgärd som mest förbättrar kvaliteten på prostatabiopseringen.
Histopatologisk undersökning av biopsier
Huvudsyftet med diagnostiken är att avgöra om patienten har prostatacancer. Man har visat att det inte går att avgöra histopatologiskt i prostatabiopsier om det föreligger kliniskt symtomgivande prostatahyperplasi. Det är ett tillstånd som är mycket vanligt hos äldre män, och korrelationen med hyperplasins utbredning och de kliniska symtomen är svag. Det är därför en omöjlig uppgift för patologen att avgöra vilka patienter som har symptomgivande hyperplasi och vilka som har »normal« prostata.
Vidare förekommer kronisk inflammation i varierande grad hos en mycket hög andel av medelålders och äldre män, även detta med svag korrelation med kliniska symtom. Patologen bör därför vara återhållsam med att diagnostisera kronisk prostatit. Liksom prostatahyperplasi är den att betrakta som en klinisk diagnos baserad bl a på patientens uppgivna symtom. Av detta skäl besvaras prostatabiopsier utan förekomst av cancer vanligen som »benigna prostatabiopsier« eller »benign prostatavävnad«.
Bland andra entiteter som bör rapporteras finns höggradig prostatisk intraepitelial neoplasi (PIN). Detta är en atypi i körtelepitelet utan invasiv växt. Låggradig PIN är ett ospecifikt fynd utan prediktivt värde för senare cancerdiagnos och bör därför inte rapporteras alls. Däremot anses höggradig PIN vara prekursor till prostatacancer. Förekomst av denna lesion utan samtidig förekomst av cancer i biopsiserien innebär förhöjd risk för cancer i senare biopsier, sannolikt framför allt synkron cancer som missats i första biopsiomgången.
I en metaanalys av biopsistudier fann man att höggradig PIN utan samtidig invasiv cancer rapporterades i ca 5 procent av prostatabiopsiserierna [2]. Medianrisken för cancer efter en initial höggradig PIN-diagnos var 24 procent, vilket är betydligt lägre än vad som rapporterats i tidigare studier. Detta ska jämföras med en genomsnittlig cancerrisk på 19 procent efter en initialt benign diagnos hos patienter med förhöjt serum-PSA. Således får riskökningen anses måttlig, och man bör väga in andra faktorer, såsom patientens ålder, när man överväger behovet av rebiopsering. En viktig förklaring till den sjunkande risken för cancer efter PIN-diagnosen torde vara att man numera tar betydligt fler biopsier i en biopsiomgång, vilket gör att risken för att missa en samtidig invasiv cancer minskar. Höggradig PIN kan utvecklas till cancer, men detta är sannolikt ett långsamt förlopp.
I en mindre del av prostabiopsierna ses körtelatypi, där patologen har svårigheter att med säkerhet avgöra om det föreligger cancer. I sådana fall kan man ha hjälp av immunhistokemisk undersökning. Standardmarkörerna är högmolekylärt keratin och/eller p63. Båda dessa färgar basalcellsskiktet i benigna körtlar. Basalceller saknas i cancerkörtlar, och man får därför ett negativt färgningsutfall (Figur 1 och 2). Man bör dock vara medveten om att enstaka benigna körtlar också kan vara negativa. Numera använder man dessutom ofta alfametylacyl-CoA-racemas (AMACR), som är ett enzym som metaboliserar grenade fettsyror. Ofta används benämningen p504s, som är antikroppens klonnamn. AMACR är överuttryckt i de flesta prostatacancrar och negativt i de flesta benigna körtlar, men både falskt positiva och falskt negativa utfall är vanliga. AMACR måste därför, liksom basalcellsmarkörerna, tolkas med försiktighet, och grunden för prostatabiopsidiagnostiken är fortfarande konventionell morfologisk analys. I fall där immunhistokemi anses nödvändig blir det en viss fördröjning av den definitiva diagnosen. Patologen kan välja mellan att skriva ett preliminärt utlåtande som anger t ex misstanke om cancer och att avvakta med utlåtande tills även de immunhistokemiska färgningarna har granskats.
I 4 procent av biopsiserierna föreligger körtelatypi där man inte kan nå fram till definitiv diagnos trots användning av immunhistokemiska markörer [2]. I dessa fall anges att det föreligger oklar körtelatypi som inger misstanke om cancer. Eventuellt viktas utlåtandet efter hur stark denna misstanke är (från oklar atypi, där malignitet inte kan uteslutas, till avgjord misstanke om cancer). Risken för cancer i dessa fall har i en metaanalys estimerats till 39 procent, således klart högre än vid höggradig PIN [2]. Det är också angeläget att patologen använder sig av denna diagnostiska kategori med gott omdöme. Diagnosen oklar körtelatypi leder ofta till att patienten följs upp med upprepade rebiopsier, och det blir svårt att frigöra sig från cancermisstanken när den väl väckts.
Gleasongradering
Den viktigaste vävnadsbaserade prognosprediktorn vid prostatacancer är histopatologisk gradering, som numera sker enligt Gleasonsystemet. Detta graderingssystem baserar sig på körtlarnas arkitektur och deras förmåga att bilda enskilda körtelenheter. Körtelmönstren graderas enligt en femgradig skala med tilltagande upplösning av körtelstrukturen vid högre grad. Eftersom prostatacancer är morfologiskt heterogen anges två Gleasongrader (två olika grader i heterogena fall, dubblering av graden i homogena fall). En Gleasonsumma (Gleason score) bildas genom att lägga ihop de två graderna. Gleasongraderingen skapades på 1960-talet av den amerikanske patologen Donald F Gleason och har sedan dess gradvis genomgått ett flertal förändringar, delvis på grund av förbättrad förståelse av prostatacancerns biologi.
Nytt sätt att summera och tolka Gleasongradering
Gleasongraderingen genomgick en genomgripande revidering 2005 vid ett konsensusmöte organiserat av International Society of Urological Pathology (ISUP) [3]. I den ursprungliga definitionen av Gleasonsumma användes de två kvantitativt dominerande graderna, men efter ISUP-revisionen ska Gleasonsumma på mellannålsbiopsier alltid inkludera den högsta graden. Detta är således ett avsteg från tidigare graderingspraxis och har bidragit till en generell trend till uppgradering av prostatacancer. Vi kunde tidigare bortse från minimala områden (<5 procent) med höggradig cancer i fall som i övrigt innehöll grad 3 och rapportera Gleasonsumma 3 + 3 = 6 (med fokal förekomst av grad 4). I dag skulle ett sådant fall rapporteras som Gleasonsumma 3 + 4 = 7.
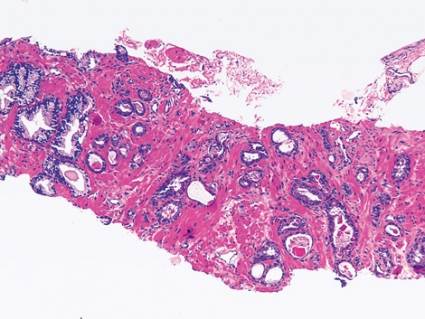
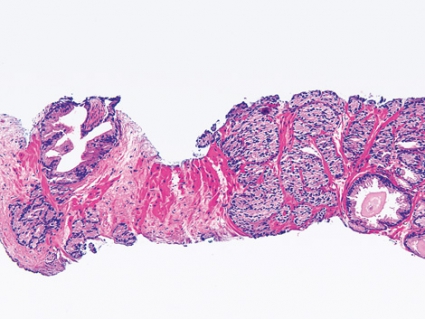
Numera används nästan aldrig Gleasonsumma under 5, och i särklass vanligaste Gleasonsumma är 6 och 7. Det är viktigt att förklara för patienten att Gleasonsumma 6 inte innebär att man befinner sig på mitten av en graderingsskala, som teoretiskt löper från 2 till 10. Grovt förenklat kan man säga att Gleasonsumma 6 är låggradig cancer, där exspektans kan vara aktuell, särskilt hos äldre patienter med liten tumörbörda (Figur 3). Gleasonsumma 7 har aggressiv potential men kan fortfarande vara botbar, och då brukar ofta kurativt syftande behandling erbjudas, särskilt om patienten är yngre.Gleasonsumma 8–10 är höggradig cancer med allvarlig prognos, där man dock någon gång kan försöka genomföra prostatektomi om tumörbördan inte är alltför stor (Figur 4). Denna mall får tas med en stor nypa salt men ger ändå en fingervisning för den allmänpraktiserande läkaren om hur gradinformationen kan tolkas.Cancerutbredning
Preoperativ bedömning av tumörstadium är mycket vansklig [4]. Prostatakapseln är en dåligt definierad struktur, och man föredrar numera termen extraprostatisk växt eller extraprostatisk extension i stället för kapselgenombrott. Med rektalpalpation har man svårigheter att uppfatta små områden av extraprostatisk växt. Man har gjort försök att utveckla radiologisk teknik (framför allt MR) för att förbättra lokal stadiebedömning, men denna är ännu inte i allmänt rutinbruk.
Extraprostatisk växt kan endast undantagsvis påvisas i biopsier, delvis på grund av att predilektionsstället för spridning ut ur prostata är beläget långt lateralt vid neurovaskulära bunten. Det handlar också ofta om mycket små områden som är svåra att träffa med en biopsinål. För att kunna diagnostisera extraprostatisk växt i mellannålsbiopsi krävs växt i fettväv, vilket främst kan påvisas i fall av avancerad höggradig cancer med massiv tumörbörda. I enstaka fall kan inväxt i vesicula seminalis påvisas. Riktade biopsier mot vesiklarna tas numera mycket sällan, men ibland kommer vesikelslemhinna med accidentellt när man siktat mot basen av prostata.
Patologen ska rapportera varje biopsi separat avseende förekomst och utbredning av cancer. Man har visat att både antalet positiva biopsier och den linjära tumörutbredningen i biopsierna korrelerar med tumörstorlek och prognos, och båda dessa parametrar ska därför rapporteras [5, 6]. Rekommendationen i Sverige är att ange linjär tumörutbredning i millimeter i varje biopsi och sedan addera längderna för hela biopsiserien [1]. Detta mått ger en viss uppfattning om tumörbördan, men man ska vara medveten om att det finns betydande osäkerhet.
Ett minimalt tumörfokus i en enstaka biopsi kan innebära att patienten har en liten, kliniskt icke-signifikant cancer, men det kan också vara toppen av ett isberg. Man bör komma ihåg att biopsierna tar prov från endast en mycket liten del av prostatan, och det finns alltid risk att man missar större tumörer, särskilt i den främre, mer svåråtkomliga delen av organet. Det går således inte att garantera att en tumör är liten och ofarlig i fall där man har exempelvis 1 mm cancer i en av tio biopsier, men detta är ändå information som vägs in i behandlingsbeslutet.
Det finns en motvilja att utföra radikal prostatektomi på patienter med mycket stor tumörbörda eftersom man vet att risken då är stor att man inte lyckas avlägsna tumören radikalt. Detta är en klinisk bedömning, där man väger in många faktorer, såsom högt serum-PSA, palpationsfynd, Gleasonsumma (som korrelerar med tumörstorlek) och tumörutbredning i biopsierna. Några exakta regler finns inte för när man bör avstå från kirurgi på grund av alltför stor tumör. Viss vägledning kan dock biopsierna ge. Cancer i flertalet biopsier måste inte nödvändigtvis innebära att tumören är stor. Det kan röra sig om flera små tumörhärdar, som var för sig träffats av biopsinålen. Om däremot den linjära utbredningen (millimeter cancer) är stor är sannolikheten hög att tumören verkligen är stor. I en svensk studie var nästan samtliga tumörer stora (>4 ml) om det förelåg mer än 30 mm ackumulerad cancerlängd i biopsimaterialet [7].
Övriga prognostiska markörer
Bland övriga histopatologiska prognostiska faktorer i prostatabiopsier kan nämnas perineural invasion [4]. Man har påvisat korrelation med både stadium och prognos, men det är kontroversiellt om perineural invasion är en oberoende prognosfaktor. De flesta uropatologer rapporterar perineural invasion, men det är inte obligatoriskt, och fyndet bör inte tillmätas någon större betydelse. Lymfovaskulär invasion ses ytterst sällan i biopsier, men man har i prostatektomipreparat sett att det är en oberoende prognosprediktor.
Ett mycket stort antal studier har på senare år genomförts för att undersöka olika biomarkörers prognostiska värde. Det har många gånger gått att påvisa ett statistiskt samband mellan exempelvis proteinuttryck och risk för sjukdomsprogress, men det finns fortfarande inte några biomarkörer som används i kliniskt bruk. Skälen till detta är flera. Man har ofta haft svårt att validera resultaten i oberoende kohorter – de påvisade sambanden kan ha statistisk signifikans, men den kliniska betydelsen kan vara begränsad, och inte minst krävs att man kan påvisa att utfallet har avgörande betydelse för valet av behandling. Förhoppningsvis kommer vi dock snart att kunna se markörer på både genetisk nivå och proteinnivå som kan bidra till att identifiera vilka prostatacancrar som är aggressiva och behöver kurativt syftande behandling och vilka som kan lämnas till exspektans.
Patologins roll efter prostatektomi
Syftet med histopatologisk undersökning av operationspreparat efter cancerkirurgi är generellt att man vill fastställa cancerdiagnosen och kartlägga prognostiska faktorer som definitiv tumörgrad, tumörutbredning, histopatologiskt stadium och radikalitet. Rutiner för detta har nyligen reviderats vid ett internationellt konsensusmöte [8].
Det förekommer i enstaka fall att man inte kan påvisa cancer i prostatektomipreparatet. Detta kan ha flera orsaker. Förr var det vanligt att patienten erhöll preoperativ neoadjuvant hormonbehandling, något som kan leda till att en tumör blir svår att påvisa. Sådan behandling bör i princip inte förekomma i dag eftersom man inte kunnat påvisa några behandlingsfördelar men däremot flera betydande nackdelar, bl a onödiga biverkningar och starkt försvårad histopatologisk undersökning av preparatet. I sällsynta fall händer det dock att patienten av en välvillig doktor erhållit hormonell behandling i väntan på operation, och det är i så fall viktigt att detta tydligt framgår av remissen.
Även i fall där neoadjuvant hormonell behandling inte givits kan man ha betydande svårigheter att påvisa någon cancer i operationspreparatet. Preoperativa biopsier bör i sådana fall givetvis eftergranskas. Man bör komma ihåg att histopatologisk undersökning av prostatektomipreparat är en stickprovsundersökning. Det är rutin i Sverige att hela prostatan skivas, paraffinbäddas och snittas, men skivtjockleken är ca 4 mm och de histologiska snitten endast 4 µm. En liten biopsidiagnostiserad cancer kan således dölja sig mellan de undersökta snitten.
Även efter nedsnittning av klotsmaterialet kan man misslyckas med att identifiera cancer. Man kan överväga genetisk identitetsanalys av preoperativa biopsier och prostatektomipreparat för att säkerställa att patientförväxling inte skett, men i fall av fokal, minimal cancer i en enda biopsi är detta egentligen inte helt nödvändigt. Patienten får i sådana fall informeras om att cancern helt säkert funnits där men varit så liten att det inte gått att återfinna den vid undersökning av operationspreparatet, något som givetvis är prognostiskt gynnsamt.
Graderingen av prostatektomipreparatet skiljer sig från graderingen av preoperativa biopsier [3]. Den reviderade Gleasongraderingen där högsta grad alltid ska ingå i Gleasonsumman är inte applicerbar på operationspreparat. Här använder man i stället den konventionella definitionen av Gleasonsumma, således summan av dominerande (primära) och näst vanligaste (sekundära) Gleasongraden. Områden som upptar mindre än 5 procent av tumören ignoreras. Fokala inslag av högre grad kan rapporteras separat som s k tertiär grad. Skälet till detta förfaringssätt är att det här rör sig om en final gradering av hela tumören. Detta innebär att man kan ha diagnostiserat exempelvis Gleasonsumma 3 + 4 = 7 i biopsierna, men när man bedömer hela tumören finner man att området med grad 4 är så litet att man kan bortse från det, och i stället diagnostiseras Gleasonsumma 3 + 3 = 6. Det är dock fortfarande vanligare att man i preoperativa biopsier undergraderar tumören (på grund av samplingsfel) än övergraderar den.
Vidare görs en bedömning av tumörstadium. Prostatacancer som inte har spridit sig utanför prostata motsvarar patologiskt stadium pT2. Subindelning av pT2 finns beskriven i TNM-klassifikationen, men det råder enighet om att denna indelning är meningslös och bör överges. Som tidigare nämnts har termen kapselgenombrott ersatts med extraprostatisk växt eller extraprostatisk extension och motsvarar patologiskt stadium pT3a. Detta förekommer i upp till ca 40–50 procent av prostatektomipreparaten beroende på hur avancerade fall det gäller. I många av dessa har tumörerna kliniskt uppfattats som stadium T1c eller T2.
Andelen fall av invasion av vesicula seminalis (vesikelinvasion, stadium pT3b) har minskat drastiskt senaste decenniet, från ca 15 till några enstaka procent. Vesikelinvasion är ett allvarligt prognostiskt fynd, men innebär inte att patienten med nödvändighet kommer att få recidiv av sin cancer. Vesikelinvasion kan i avancerade fall vara palpabel preoperativt men är oftast ett överraskningsfynd vid undersökning av operationspreparatet.
I bedömning av tumörkirurgiska preparat vid cancersjukdom är radikalitetsfrågeställningen alltid viktig. Det brukar vanligen vara önskvärt med god marginal mellan tumör och resektionsrand, och en positiv resektionsrand leder ofta till utvidgad resektion eller annan tilläggsbehandling. Vid bedömning av prostatacancer är situationen något annorlunda. I prostatektomipreparat kan vi inte förvänta oss någon bred marginal eftersom utrymmet kring prostata är mycket trångt och operatören måste vara aktsam så att inte nerver skadas. För att underlätta bedömning av resektionsrandsstatus tuschmärker patologen hela prostatas resektionsytor. Definitionen av positiv resektionsrand är cancer som når fram till tuschmarkeringen. En snäv marginal har ingen prognostisk betydelse. Det är vanligt att tumören endast fokalt når fram till resektionsranden, och det är oklart om detta innebär ökad risk för recidiv.
Bedömningen av prostatektomipreparat syftar i dag i huvudsak till att avgöra sannolikheten för cancerrecidiv. I en nära framtid kommer sannolikt detta att bli allt viktigare eftersom adjuvant behandling i ökad utsträckning kommer att ges till patienter med högriskprofil. Därmed blir det allt viktigare att dessa undersökningar görs på ett standardiserat sätt och att den prognostiska informationen levereras i ett strukturerat och tydligt format.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.