Sammanfattat
Hos barn förekommer spasticitet framför allt vid cerebral pares och efter olika typer av förvärvad hjärnskada.
Spasticitet som är smärtsam eller som stör skötsel, hygien och positionering behöver oftast behandlas.
Relativt blygsamma vinster har setts då man med olika metoder behandlat spasticitet för att förbättra funktion.
Kontrakturutveckling vid cerebral pares är sannolikt multifaktoriell; trots spasticitetsreduktion uppstår kontrakturer.
Cerebral pares (CP) är den vanligaste anledningen till att barn och unga i den industrialiserade världen rör sig annorlunda eller har en avvikande motorik jämfört med typiskt utvecklade jämnåriga. Prevalensen är drygt 2 promille bland barn födda i Sverige och 6 promille bland barn inflyttade till Sverige [1, 2]. Sammantaget uppskattas ca 5 000 barn och unga i Sverige ha CP. Spasticitet är ett av de vanligaste motoriska symtomen, och 90 procent av alla barn med CP har spasticitet av varierande omfattning. Spasticitet hos barn ses framför allt vid CP och efter olika typer av förvärvad hjärnskada men förekommer också vid en rad olika metabola tillstånd.
Spasticitet anses bero på ökad excitabilitet av den spinala sträckreflexen. En grundförutsättning är en skada på centrala nervsystemet någonstans mellan motorkortex och ryggmärgen, som innefattar kortikospinala och kortikoretikulospinala banor. Detta leder till förändrad bakgrundsaktivitet i alfa-motorneuron och de segmentella interneuronen; via en rad olika mekanismer reduceras och förändras den spinala inhibitionen, vilket ger ökad excitabilitet hos den spinala sträckreflexen.
En spastisk muskel har ökad spänning eller tonus; detta undersöks kliniskt genom att muskelns rörelseomfång testas passivt vid olika hastigheter. Vid spasticitet, till skillnad från andra tillstånd med ökad muskelspänning (dystoni och rigiditet), är motståndet som undersökaren känner hastighetsberoende och ökar om extremiteten förs snabbt fram och tillbaka över leden. Oftast är också senreflexer stegrade, ibland med klonus och positivt Babinskis tecken.
Svår spasticitet är ofta smärtsam och energikrävande
Den ökade muskeltonusen försvårar eller förhindrar automatiserade och viljemässiga rörelser. Yttre faktorer som höga ljud, stress och känslomässig anspänning förvärrar ofta spasticiteten, liksom samtidiga hälsoproblem, t ex infektioner, smärta och förstoppning. Svår spasticitet är ofta smärtsam och energikrävande. Barn med uttalad spasticitet är vanligen tunna, smala och med dålig nattsömn.
Det är dock viktigt att minnas att spasticitet bara är ett av de motoriska symtomen vid CP. Andra motoriska symtom och/eller samtidiga neurologiska tillstånd som synproblem, epilepsi eller kognitiva svårigheter kan ha större betydelse för barnets funktion och möjlighet till delaktighet och social integration. För enstaka svaga barn kan också en viss spasticitet i nedre extremiteterna vara till nytta: spasticiteten används till att »stå på« vid t ex förflyttning från rullstol till toalett.
Ett beslut att behandla spasticitet innebär att barnets övriga motoriska symtom, t ex bålhypotoni och svaghet, beaktats liksom familjens och barnets livssituation.
Behandling för att förbättra barnets vardagssituation
Finns endast mer fokala tonusökningar träffar barnet oftast barnneurolog och barnortoped tillsammans med sin habiliteringssjukgymnast för ställningstagande till behandling.
Vid svår generell spasticitet finns på de flesta universitetskliniker s k spasticitets- eller tonusteam, dvs multiprofessionella team där, förutom barnets ordinarie sjukgymnast, arbetsterapeut och barnneurolog/habiliteringsläkare, oftast barnortoped, neurokirurg, barnneurolog, sjukgymnast, ortopedingenjör och sjuksköterska med specialintresse inom svår tonusreduktion deltar i behandlingsbesluten.
Det övergripande syftet med all behandling är att förbättra barnets vardagssituation. Vanliga specifika indikationer för spasticitetsreduktion är smärtlindring, förenklad hygien och förbättrad ADL-situation, bättre positionering i rullstol eller specialsits samt förenklad användning av ortoser eller skenor. Ofta finns också ett önskemål och förhoppning om förbättrad funktion, grovmotorisk eller finmotorisk.
Evidensbaserade studier som tydligt, i ett funktionellt perspektiv, stöder en speciell behandlingsstrategi är relativt få och oftast har kortare behandlingsinsatser utvärderats. Anledningarna till detta är flera; gruppen med spasticitet är i alla avseenden heterogen, och tilläggsproblematik påverkar utfallet av de flesta funktionella parametrar. Att som vuxen drabbas av en sjukdom innebär förlust av en tidigare normal förmåga. Hos barn med tidig eller förvärvad hjärnskada måste behandlingsutfallet utvärderas gentemot det »bakgrundsbrus« av normal utveckling som alla barn, också barn med en funktionsnedsättning, genomgår över tid.
Behovet av randomiserade studier med en kontrollgrupp blir då extra stort, men det är heller inte etiskt att avstå behandling i kontrollgruppen för mer än korta perioder. Under senare år har flera långtidsstudier tillkommit, vanligen icke-randomiserade, där olika typ av spasticitetsreduktion utvärderats [3-6].
Sjukgymnastik är basbehandling för de flesta barn med CP
Basbehandlingen för de flesta barn med CP utgörs av sjukgymnastik. Syftet med den sjukgymnastiska behandlingen är inte primär spasticitetsreduktion utan förbättrad balans, motorisk kontroll, ledrörlighet och avslappning. Detta och identifiering av ställningar där spasticiteten bryts kan ge en viss sekundär tonusminskning.
Omfånget ofta avgörande för val av behandlingsmetod
Om spasticiteten behöver behandlas, är omfånget ofta avgörande för valet av behandlingsmetod. Vid fokal spasticitet, där uppemot en handfull muskler ska behandlas, är oftast lokal injektionsbehandling aktuell, medan generell spasticitet kräver peroral eller annan form av systemiskt tillgänglig behandling.
Intramuskulär botulinumtoxin A-injektion ger lokal effekt
Vad gäller intramuskulära injektioner som behandling används i praktiken bara ett preparat: botulinumtoxin A, det mest potenta naturliga neurotoxinet. Botulinumtoxin A är godkänt i Sverige sedan 15 år för behandling av tågång vid CP (vadmuskelspasticitet) från 2 års ålder. Två icke-dosekvivalenta preparat finns att tillgå (Botox och Dysport).
Toxinet verkar genom att selektivt med hög affinitet binda till kolinerga nervändslut, där frisättningen av acetylkolin förhindras. Effekten blir en reversibel dosberoende kemisk denervering, som förhindrar/reducerar muskelaktivitet under 3–6 månader. Den spasticitetsreducerande effekten är således lokal genom en direkt påverkan på perifer nerv och muskel.
Bedöms som en säker behandling. Biverkningarna är få: lokal smärta vid injektionsplatsen, ändrat gångmönster och svaghet är vanligast hos barn med CP som får behandling i nedre extremiteten. Under senare år har fall av generell svaghet och även dödsfall rapporterats. Detta har lett till sammanställning och publicering av en rad omfattande översiktsartiklar [7-9].
Sammanfattningsvis har botulinumtoxin A givits till tiotusentals barn och bedöms vara en säker behandling; i enstaka fall har generell svaghet rapporterats. Försiktighet rekommenderas därför vid behandling av barn med känd andningsproblematik, framför allt barn med CP och låg grovmotorisk funktionsnivå. Till stöd för behandlande läkare finns också omfattande konsensusdokument där evidens, klinisk erfarenhet och praxis hos en rad kliniker och experter sammanställts [10, 11].
Smärtsam fokal spasticitet är en indikation. Kliniskt övervägs ofta behandling med botulinumtoxin A om det finns smärtsam fokal spasticitet, om spasticiteten försvårar eller förhindrar användningen av ortoser (ortoser eller skenor förbättrar balans och stabilitet i gående men kan även användas för t ex upprättstående med s k ståskal med syfte att belasta skelett, öka social integration och underlätta hand- och armmotorik).
Om barnet har stannat av på en platå i sin motoriska utveckling och detta bedöms orsakat av fokal spasticitet, väljer man ofta också behandling med botulinumtoxin A. Exempelvis uppfattar man ofta att det för många barn kan vara lättare att börja gå självständigt om en spasticitet i gastrocnemius som leder till tågång reduceras eller om armen kan pendla med vid gång.
Noggrann kartläggning av musklerna krävs. Den vetenskapliga evidensen anger dock som bäst blygsamma funktionella vinster i kortare perspektiv [8]. En nyligen uppdaterad Cochrane-översikt har visat relativt god evidens för att botulinumtoxin A-injektioner kombinerade med träning minskar tonus i övre extremiteten men att det är svårt att uppnå funktionella förbättringar [12].
Ny forskning har visat att upprepade injektioner ger fortsatt god tonusminskning när vadmuskeln injicerats; detta har inte förhindrat en kontrakturutveckling men möjligen senarelagt (dvs förbättrat) denna [4]. En australisk långtidsstudie kunde också visa att upprepade injektioner i höftadduktorerna inte kunnat förhindra successiv subluxation av höftleden [13].
Vid all behandling med botulinumtoxin A hos barn bör beslutet om vilka muskler som ska behandlas vara resultatet av en noggrann kartläggning. Vid injektion bör EMG, muskelstimulering eller ultraljud användas för att säkert identifiera vilken muskel som behandlas. Särskilt viktigt är detta för små muskler. Injektionerna är förenade med s k procedursmärta; effektiv smärtlindring, t ex med lustgas, är därför viktig.
Perorala preparat vid generellt ökad tonus
Vid generellt ökad tonus är peroral medicinering förstahandsvalet. Särskilt gäller detta om tonus är smärtsam eller om den negativt påverkar sömn, skötsel och hygien.
Bensodiazepiner och baklofen ökar spinal inhibition. Bensodiazepiner, t ex klonazepam och diazepam, har mycket god spasticitetsreducerande effekt men har dosberoende biverkningar i form av sedation med påverkan på kognition och beteende [8, 14]. För klonazepam gäller också att en del kan få ökad slembildning av den grad att behandlingen måste avbrytas. Bensodiazepiner verkar genom en postsynaptisk GABA-facilitering vid GABAA-receptorer.
Peroralt baklofen sänker effektivt tonusen både vid spasticitet och dystoni. Baklofen är en GABA-agonist som verkar genom att såväl pre- som postsynaptiskt binda till GABAB-receptorer och på så vis inhibera mono- och polysynaptiska reflexer på bl a spinal nivå. Även här är biverkningarna dosberoende, men genom långsam dostitrering kan höga dygnsdoser ofta tolereras väl. De vanligaste biverkningarna är dåsighet, trötthet, yrsel, huvudvärk och illamående. Baklofen kan i sällsynta fall sänka kramptröskeln hos patienter med epilepsi.
Det är ofta lämpligt att börja med 5 mg × 3 och sedan öka med 5 mg/vecka till dess man får mesta möjliga tonusreduktion med bibehållen möjlighet till viljemässiga aktiva rörelser utan störande biverkningar. Det är stora individuella skillnader i vad som är en effektiv dos. I en amerikansk retrospektiv journalstudie fick barn med CP i medeltal 2 mg/kg och dag (variationsvidd 0,14–9,9 mg/kg och dag), och dessa dosnivåer har använts vid Astrid Lindgrens barnsjukhus i Stockholm under ett decennium med god effekt för många patienter [15].
Alfa-2-agonister minskar spinal excitation. En tredje preparatgrupp, alfa-2-adrenerga agonister, minskar i stället den spinala excitationen. Alfa-2-agonister används ofta i övriga Europa och i Nordamerika som både enskilt preparat och tilläggspreparat. I Sverige kan vi förskriva klonidin ex tempore för peroralt bruk. Alfa-2-agonisten klonidin, som också har analgetiska egenskaper, kan vara en effektiv terapi vid den svåra spasticitet som ofta uppstår tidigt efter asfyktisk eller traumatisk hjärnskada.
Neurokirurgiska behandlingsmetoder
Det finns två neurokirurgiska behandlingsmetoder: intratekal baklofenpumpsbehandling, som ger generell tonusreduktion, och selektiv dorsalrotsrizotomi, som eliminerar spasticitet från höfter och neråt. De bygger båda på samma princip – grovt sett att återskapa den reglering av alfa-motorneuronet som är störd på spinal nivå.
Selektiv dorsalrotsrizotomi ger permanent effekt. Vid selektiv dorsalrotsrizotomi skärs afferenta excitatoriska nervfibrer av där de går in i ryggmärgens dorsalhorn. På så vis erhålls en permanent spasticitetsreducerande effekt och även viss effekt på grovmotorisk funktion när operationen följs av intensifierad sjukgymnastisk träning [3, 16]. Däremot har man inte, trots avsaknad av spasticitet, kunnat förhindra en successiv kontrakturutveckling i nedre extremiteterna; tio år efter selektiv dorsalrotsrizotomi har de allra flesta patienter genomgått ett flertal ortopediska kontrakturoperationer [3, 6].
Selektiv dorsalrotsrizotomi används framför allt hos barn med bilateral CP (diplegi enligt tidigare klassifikation) och som kan gå och har god styrka.
I Sverige utförs i dag mycket få rizotomioperationer. Anledningarna är flera: dels finns i dag ett större utbud av spasticitetsreducerande terapier än då selektiv dorsalrotsrizotomi infördes som metod i början på 1990-talet, dels avskräcks många föräldrar av ingreppets permanenta art.
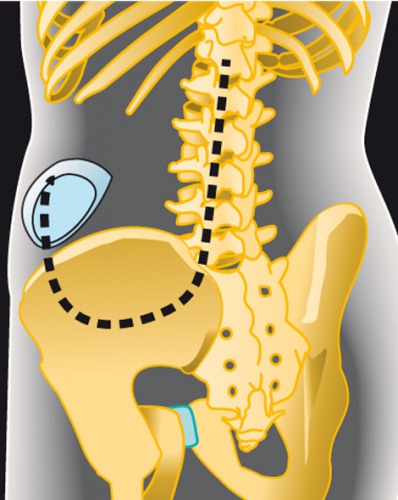
Intratekal baklofenpump vid svår spasticitet. Intratekal baklofenpumpsbehandling innebär att en pump som kontinuerligt avger baklofen placeras under muskelfascian på buken. Från pumpen går en kateter under huden och in i spinalkanalen (Figur 1).
Pumpen fylls på genom transkutan injektion, vilket är en smärtfri procedur med hjälp av bedövningskrämen EMLA. Programmering av pumpen sker via en extern portabel programmerare. När pumpen opererats in sker dosjusteringar och påfyllningar på särskild mottagning, där barnneurolog eller neurokirurg ansvarar. Komplikationer med kateteravbrott eller katetrar som kryper ut ur spinalkanalen är relativt vanliga och drabbar ca 20 procent av patienterna.
Metoden används huvudsakligen för patienter med uttalad och svår generell spasticitet eller dystoni för att reducera smärta och förenkla skötsel, hygien och positionering. Det finns god evidens för att intratekal baklofenpumpsbehandling har goda tonussänkande egenskaper både vid spasticitet och vid dystoni, men också för att skötsel och livskvalitet förbättras hos gruppen barn med den svåraste formen av tonusproblematik [17-20].
*
Potentiella bindningar eller jävsförhållanden: Kristina Tedroff har föreläst om behandling och felsökning vid intratekal baklofenpumpsbehandling vid svenska och internationella möten då medicinteknikföretaget Medtronic bekostat resa och lönebortfall.
*
Kristina Tedroff är medlem i Stockholms läns läkemedelskommittés expertråd för neurologiska sjukdomar.