Sammanfattat
Kartläggningen av och behandlingen mot de sekundära skademekanismerna (neuroprotektion) som ligger bakom en ryggmärgsskada har inneburit en stor besvikelse vad gäller möjligheten för de ryggmärgsskadade patienterna att återfå förlorad neurologisk funktion.
Regenerationsforskningen syftar till att möjliggöra tillväxt och/eller omformning via nervvävnadens plasticitet.
I artikeln presenteras en översikt över forskningen kring neuroprotektion och regeneration med fokus på olika regenerationsstrategier för att övervinna hinder på såväl nervcellsnivå som i dessa cellers omgivning.
År 1911 introducerade Reginald Allen den första moderna försöksmodellen för att djurexperimentellt framkalla en skada mot ryggmärgen. Han var, liksom »neurovetenskapens fader« Santiago Ramón y Cajal, redan vid den tidpunkten medveten om att även sekundära skademekanismer bidrog till det slutliga neurologiska bortfallet efter ett trauma mot ryggmärgen. Stora ansträngningar har sedan dess gjorts för att kartlägga olika skademekanismer i det akuta skedet (se nedan). Under de senaste decennierna har fokus dock flyttats från händelserna i det omedelbara skeendet efter traumat till de mer långsiktiga konsekvenserna av en ryggmärgsskada. I denna artikel ges en kortfattad översikt över kirurgiska, farmakologiska och transplantationsrelaterade åtgärder inom forskningen kring ryggmärgsskador. En mer utförlig presentation av ämnesområdet, som även innehåller detaljerade referenslistor, ges i de tre första referenserna [1-3].
Neuroprotektion
Med neuroprotektion avses åtgärder som syftar till att förhindra de sekundära skademekanismerna och/eller de självdestruerande processernas förmåga att förstöra neuroner i ryggmärgsvävnaden i skedet efter den initiala, primära (mekaniska) skadan [4].
Kartläggningen av de sekundära skademekanismerna fokuserades under 1970-talet på ödemutveckling, bildningen av fria radikaler och frisläppandet av noradrenalin. Kalciumprocesser, opiatreceptormekanismer, cytokinmetabolism och betydelsen av kväveoxid i skadad vävnad belystes under 1980-talet, medan kunskapen om apoptos, energimetabolism, inflammatoriska processer och excitotoxicitet ökade markant under 1990-talet.
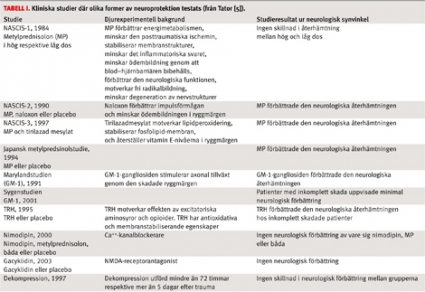
Förekomsten av så många tänkbara skademekanismer innebar en möjlighet att framför allt djurexperimentellt testa ett stort antal substansers neuroprotektiva förmåga. Forskningen inom området neuroprotektion har fokuserats även på ett antal kliniska studier i syfte att minska det neurologiska bortfallet efter trauma. I en sammanställning av Tator från 2006 [5] presenteras de kliniska studier som författaren ansåg vara mest tillförlitliga ur vetenskaplig synvinkel (Tabell I).
Som framgår av denna heltäckande översiktsartikel har kartläggningen av och behandlingen mot olika sekundära skademekanismer inneburit en stor besvikelse vad gäller möjligheten att med farmakologisk behandling i det akuta skedet hjälpa patienter att återfå förlorad neurologisk funktion. Av alla neuroprotektiva substanser är det endast metylprednisolon (kortison) som använts i klinisk praxis. Behandling med metylprednisolon anses idag inte vara standardbehandling utan snarare ett möjligt behandlingsalternativ (optional treatment). Metylprednisolon har egentligen varit det enda terapeutiska resultatet av all forskning kring neuroprotektion, men även denna terapi har således starkt ifrågasatts [6].
I neuroprotektionssyfte har även andra tillämpningar än farmakologiska undersökts kliniskt. Varken exempelvis tidig dekompression (avlastning av ryggmärgen via ett operativt ingrepp) eller behandling med hypotermi har dock signifikant förbättrat den neurologiska återhämtningen. Besvikelsen över de uteblivna effekterna av de neuroprotektiva åtgärderna är stor. I stället ställs nu stora förhoppningar till forskningen inom ämnesområdet regeneration.
Regeneration
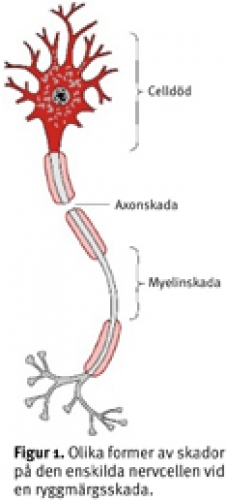
Regenerationsforskningen, den mest spektakulära delen av forskningen kring ryggmärgsskador, syftar till att möjliggöra tillväxt och/eller omformning via nervvävnadens plasticitet [2]. Efter en ryggmärgskada är nervvävnaden i ett mycket dåligt skick, och förutsättningar finns för olika former av skada på den enskilda nervcellen (Figur 1). Impulsledningsförmågan i ryggmärgens ledningsbanor blir nedsatt eller upphävs på grund av att myelinet som omger axonen förstörts (Figur 1). Alla in- och utgående impulser upphör vid skadenivån som om den enda telefonkabeln från en transformator klippts av. Drömmen är givetvis att kunna utföra en »kabelsammankoppling på ryggmärgsnivå« så att delar av funktionen nedanför skadenivån återkommer.
I det vuxna nervsystemet finns en miljö som normalt motverkar tillväxt av axon. I det akuta såväl som i det sena skedet efter en skada mot ryggmärgen startar olika processer på nervcellsnivå och i nervcellens omgivning för att hindra denna tillväxt. Dessa processer motverkar nervcellens förmåga att just växa i längd, passera skadenivån samt återfinna och sammankoppla sig till nervceller nedanför skadenivån. Här presenteras olika regenerationsstrategier för att övervinna dessa hinder såväl på nervcellsnivå som i nervcellers omgivning.
Regenerationsstrategier
Om axonal regeneration eller tillväxt ska bli möjlig krävs att hindren i såväl själva nervcellen som dess omgivning angrips. Regenerationsstrategierna för att möjliggöra axonal tillväxt har enligt vår egen tolkning tre huvudmoment: De ska stimulera nervcellens inre regenerationskapacitet och förhindra tidiga såväl som sena hämmande effekter på axonal tillväxt i nervcellens omgivande miljö.
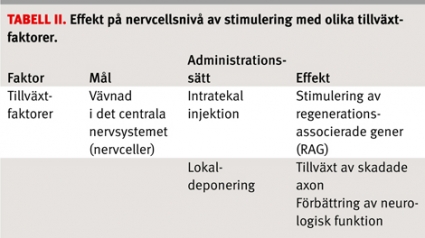
Stimulering av inre regenerationskapacitet. Neuronen innehåller ett inaktiverat »regenerationsmaskineri« som aktiveras vid stimulering av så kallade regenerationsassocierade gener, RAG (regeneration associated genes) [7]. Tillväxtfaktorer, även benämnda neurotrofa faktorer eller neurotrofiner, har flera tillväxtstimulerande egenskaper (Tabell II). Sannolikt påverkar dessa tillväxtfaktorer RAG till att stimulera regenerationskapaciteten hos de skadade neuronen. Sammantaget har man med ett stort antal väl definierade tillväxtfaktorer visat att det går att påverka regenerationen på ryggmärgsnivå genom att starta om och under en längre tid upprätthålla regenerationsmaskineriet i nervcellen.
Strategier mot tidiga hämmande effekter. I den tidiga perioden efter ett trauma förhindras axonal tillväxt genom att den omgivande miljön motverkar bildningen av myelin, eller genom att faktorer i denna miljö påskyndar bildningen av ärrvävnad, håligheter och cystor både i och kring ryggmärgen. Här presenteras fyra strategier för att motverka de tidiga hämmande effekterna i nervcellernas omgivande miljö, vilka kan användas så länge ärrbildningen fortfarande pågår i skadenivån (Tabell III).
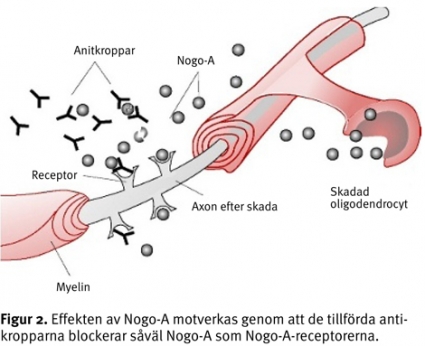
Vi vet att myelin innehåller hämmare för regeneration. Nogo-A är en proteinkomponent i myelinet som produceras av oligodendrocyterna och vars uppgift är att under normala förhållanden förhindra neuron att växa (Tabell III) [8]. Efter en skada motverkas på samma sätt den önskade axonala tillväxten (Figur 2). Genom att applicera antikroppar, exempelvis IN-1, som binds till Nogo-A (neutraliserande antikropp) eller till antagonister mot Nogo-receptorn tycks regenerationen underlättas [9]. När ett axon demyeliniseras efter en skada försämras eller upphör impulsledningen. Ett stort antal kaliumkanaler kommer att vara blottade och kaliumjoner läcker ut, vilket bidrar till att impulsförmedlingen kortsluts. Ämnet fampridin-SR (4-amino-pyridin, 4-AP) stänger de öppna kaliumkanalerna och tillåter därigenom axoner att fortleda impulser även i ett demyeliniserat tillstånd (Tabell III) [10].
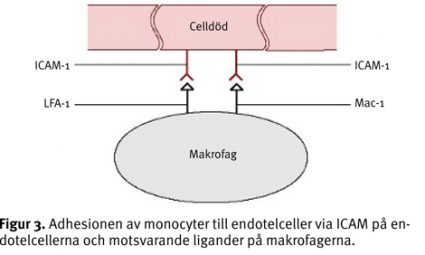
Om det inflammatoriska svaret kan minskas efter ett trauma förbättras miljön för tillväxt av nervcellerna. Avsaknad av makrofager i ett skadeområde bidrar till en miljö där skadade produkter bryts ned ytterst långsamt, vilket försämrar förutsättningen för axon att senare regenerera [11]. När makrofagerna kommer till skadeområdet behöver de fästa sig på endotelcellerna i kapillärerna för att därefter passera över blod–hjärnbarriären och komma in i den skadade ryggmärgsvävnaden.
På makrofagerna och endotelcellerna finns så kallade celladhesionsmolekyler, CAM (Figur 3). Intercellulär adhesionsmolekyl, ICAM (intercellular adhesion molecule), är ett exempel på en CAM som finns på endotelcellernas yta. Om monoklonala antikroppar ges mot dessa ICAM-molekyler på endotelcellens yta motverkas makrofagernas vandring in i ryggmärgsvävnaden (Tabell III). Målsättningen är att reglera ICAM så att skadeområdet innehåller en adekvat mängd makrofager. Detta skulle innebära att tillräckligt många makrofager finns för att sköta nedbrytningen av skadade produkter samtidigt som ingen »onödig« ärrbildning uppstår.
Interleukin 10 (IL-10), som tillhör gruppen cytokiner, produceras av makrofagerna i slutstadiet av immunsvaret. Förenklat medverkar interleukinerna till att stänga av det inflammatoriska svaret [12]. Genom att ge IL-10 i ett tidigt skede av det inflammatoriska svaret kan effekten bli att detta förkortas alternativt stängs av.
Svårigheter är givetvis att veta när makrofagsvaret kommer, vilket man måste känna till för att kunna tillföra till exempel monoklonala antikroppar mot ICAM-1 och interleukiner vid rätt tidpunkt, och på så sätt balansera de positiva effekterna av det initiala inflammatoriska svaret respektive stänga av det när de negativa effekterna börjar göra sig gällande.
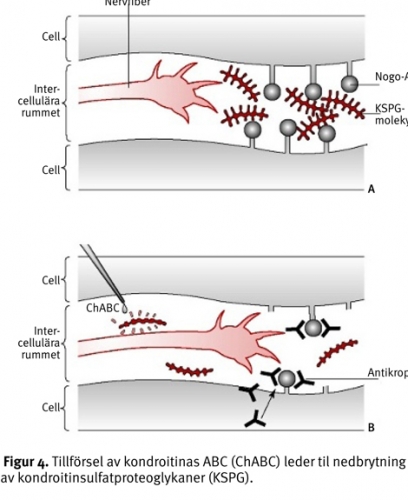
Kondroitinsulfatproteoglykaner (KSPG) är en typ av molekyler i den extracellulära matrixn som deponeras i en ökad mängd vid en ryggmärgsskada. Detta är ett naturligt svar efter en skada. Samtidigt bidrar KSPG starkt till den ärrbildning som är fientlig för de axon som försöker regenerera. Ett bakteriellt enzym, kondroitinas ABC (ChABC), fungerar som en molekylär machete genom att bryta ned proteoglykaner och minska det mekaniska hindret för nervregeneration (Figur 4). Tillförsel av detta enzym till försöksdjur med ryggmärgsskada har visat sig stimulera skadade axon regenerationsförmåga (Tabell III) [13].
Strategier mot sena hämmande effekter. De sena inhibitoriska strategierna påbörjas när ärrkakan är färdigbildad runt ryggmärgen. Begreppet »filling the gap« används ofta i den anglosaxiska litteraturen för att beskriva olika metoder som syftar till att brygga över detta mekaniska hinder. I begreppet innefattas bland annat användning av olika former av stödjestrukturer (Tabell IV) och metoder för transplantation vid reparation av skadad ryggmärg (Tabell V).
Att använda broar som fungerar som tillväxtbefrämjande stödstrukturer i skadenivån, i kombination med olika former av celler, kan förhoppningsvis underlätta den axonala tillväxten. Stödjestrukturernas syfte är att stimulera regenerationen genom att fungera som ett tillväxtsubstrat för tillväxtfaktorer och olika cellersättningsformer i stimuleringen av axonal tillväxt.
Ett av de mer lovande experimenten inom detta område publicerades av Cheng et al 1996 [14]. Perifera nervgraft (interkostalnerver) kombinerades med ett speciellt stabiliserande lim som innehöll fibroblasttillväxtfaktorn FGF (Tabell IV). De påvisade både strukturella och funktionella förbättringar från såväl ned- som uppåtgående långa axonbanor.
Genom att isolera proteinkomponenter ur schwannska celler från perifera nerver har man kunnat konstruera en speciell stödjestruktur eller guidance channel [15]. Problemet med att använda Schwannska celler är att astrocyterna i skadeområdet reagerar mot dessa celler, vilket minskar de schwannska cellernas förmåga att producera myelin (Tabell IV).
Buntar av luktnervcellernas axon bildar tillsammans fasciklar, vilka omges av en typ av stödjeceller som kallas olfactory ensheathing glia cells, OEC. OEC är en speciell typ av gliaceller som har regenerationstimulerande egenskaper (Tabell IV). Epokgörande studier har visat att lokalt implanterade OEC stimulerar återväxt av avskurna sensoriska axon in i ryggmärgen och bidrar till att axon kan ta sig förbi ärrvävnad [16]. Man har även registrerat en viss funktionell förbättring av sensoriska funktioner och balans. OEC hämmas inte som Schwannska celler av astrocyterna och är därför mer användbara som stödjestruktur för tillväxt över en viss skadenivå. OEC har transplanterats till ett fåtal patienter med ryggmärgsskada bland annat i Brisbane, Australien.
Olika former av artificiella stödstrukturer används således för att överbrygga och sammanlänka ryggmärgsvävnad ovanför och nedanför skadenivån.
Transplantation av vävnad respektive stamceller
Försök görs att på olika sätt använda embryonal vävnad eller fostervävnad respektive stamceller vid reparation av skadad ryggmärg. Översiktsartiklarna i referenslistan till den här artikeln ger tillfälle att inhämta fördjupade kunskaper inom detta ämnesområde [17-20].
Transplantation av embryonal vävnad/fostervävnad har som syfte att dels ersätta skadade neuron så att synapsaktivitet kan återuppstå, dels minimera antalet skadade neuron och bildningen av ärrvävnad. Transplanterad embryonal vävnad/fosterväv-nad tänks också kunna fungera som relästation där ascenderande eller descenderande impulser kan avslutas och därefter överföras via axoner från transplanterade celler till neuron belägna ovanför eller nedanför skadenivån. Ett annat syfte är att underlätta regeneration och omforming via nervvävnadens plasticitet. Sammanfattningsvis visar studier att human fostervävnad som transplanterats till skadad ryggmärg hos försöksdjur underlättar överlevnad och tillväxt av vissa skadade nervceller (Tabell V).
Även försök med transplantation av human fostervävnad till ryggmärgsskadade patienter har genomförts. Genom implantation av embryonal vävnad/fostervävnad direkt i det skadade området i ryggmärgen hoppas man kunna fördröja/avstanna utvecklingen av bland annat en syringomyeli (ryggmärgscysta) mindre snabb. Det är viktigt att påpeka att transplantation av fostervävnad i dagsläget inte syftar till att förbättra patienternas neurologiska funktion utan utförs enbart för att studera om den transplanterade vävnaden accepteras och integreras av mottagarens skadade ryggmärg.
Stamcellsforskningen har öppnat en ny arena i den regenerativa vetenskapen. I december 1996 presenterades den första rapporten om att embryonala musstamceller som injicerats till ryggmärgsskadade råttor resulterat i en förbättrad neurologisk funktion hos försöksdjuren. Försöken bekräftade att embryonala stamceller både kunde överleva och differentiera i mottagarvävnaden. Stamcellsforskningen är i dag ett av de få områden där bevis finns för att cellterapi kan reparera skador i det centrala nervsystemet och återställa förlorad funktion.
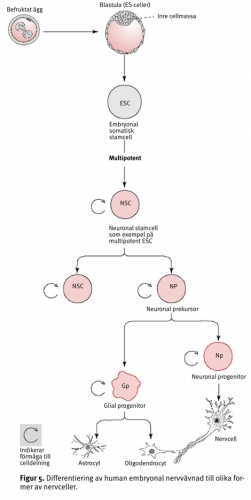
Embryonala stamceller. Den vuxna människan består av 200 olika typer av celler. Alla dessa har sitt ursprung från en enstaka totipotent cell, nämligen zygoten eller det befruktade ägget (Figur 5). Embryonala stamceller (ES) hämtas från embryon i blastocyststadiet, vilka utvecklats från ägg befruktade in vitro och som därefter donerats till forskning efter medgivande av donatorn. De embryonala stamceller som används härstammar således inte från ägg som befruktats i en kvinnas kropp.
Stamceller är källan till alla celler i kroppen. De fungerar som ett slags reparationssystem och kan teoretiskt dela sig utan begränsning och ersätta andra celler så länge individen lever. De embryonala stamcellerna innehåller en full uppsättning av normala kromosomer. De kan ge upphov till differentierade celltyper och uppvisar klonogena egenskaper (det vill säga de kan ge upphov till en koloni av genetiskt identiska celler).
Adulta stamceller. Stamceller kan, förutom i blastocysten, påträffas i ryggmärgsvävnad från foster och i vävnad från vuxna (adulta stamceller). Deras primära funktion är att bibehålla ett jämviktsläge med avseende på cellkapaciteten genom att ersätta celler som dör av skada eller sjukdom. Upptäckten av regenerationskapacitet i det vuxna centrala nervsystemet gav hopp om nya möjligheter att reparera vävnad efter traumatiska skador och degenerativa sjukdomar i det centrala nervsystemet. En viktig framtidsuppgift blir därför att generera humana adulta stamceller som kan användas i cellbaserade terapier.
Stamceller vid reparation av skadad ryggmärg. Vid ett traumatisk ryggmärgstrauma involveras ett flertal celltyper. Ersättningsprocessen blir därför mer omfattande och komplicerad än vid behandling av till exempel Parkinsons sjukdom, där enbart dopaminproducerade celler behöver ersättas. Syftet med stamcellsforskningen är i första hand att reparera förlorad vit vävnad, och ofta talas det om partiell reparation av ryggmärgsvävnaden.
De överlevande axonen där myelinet är skadat/förstört har ingen möjlighet att leda impulser. Det första steget vid stamcellsanvändning blir därför att lära sig hur man ersätter de myelinproducerande cellerna, oligodendrocyterna. Epokgörande experiment har visat att det går att använda stamceller så att remyelinisering kan ske efter en traumatisk skada mot ryggmärgen.
Målsättning. Ett viktigt mål för stamcellsforskningen är att utveckla specialceller och att styra differentieringen av humana pluripotenta embryonala stamceller till en speciell typ av celler, till exempel neuroner. Forskarna börjar förstå de humana embryonala stamcellernas biologi men många frågor återstår.
Många av dagens metoder har som syfte att generera human vävnad för transplantation, som betaceller vid diabetes, neuron för att frisläppa dopamin vid Parkinsons sjukdom och hjärtmuskelceller för att ersätta vävnad vid till exempel hjärtsvikt. Det viktigaste användningsområdet för ES-cellerna blir dock inom överskådlig framtid av vetenskaplig karaktär snarare än terapeutisk, även om framodlade embryonala stamceller implanterats på människa i enstaka fall.
Framtidsvisioner
Utmaningen att »bota förlamningen« efter en ryggmärgsskada kvarstår. Det »gyllene läkemedlet« eller den »gyllene behandlingen« har ännu inte tagits fram. Däremot har nya frågeställningar uppstått för varje ny kunskapsbit som adderats till vårt vetande. En av de viktigaste uppgifterna är att skapa ett klimat för multidisciplinärt samarbete genom att bygga broar mellan grundforskare och kliniskt aktiva kollegor.
Följande frågeställningar behöver få ett multidisciplinärt eller tvärvetenskapligt omhändertagande för att kunna besvaras:
• Vilken är betydelsen av alla sekundära mekanismer i förhållande till framtida grad av neurologiskt bortfall?
• Hur ska vävnaden behandlas i det akuta stadiet så att den i ett senare skede lämpar sig för regenerationsbehandling, det vill säga hur ska den kemiska miljön stabiliseras initialt så att överlevande vävnad bibehålls i ett så gott skick som möjligt?
• Innebär resultaten från regenerationsforskningen att vi ska ändra vår attityd till behandling av patienterna i det akuta skedet?
• Är det meningsfullt att kirurgiskt avlasta ryggmärgen och stabilisera kotpelaren hos alla patienter med ryggmärgsskada? Ska vi i stället i framtiden, i vissa fall, använda fostervävnad, stamceller, OEC, tillväxtfaktorer eller andra stödjestrukturer ensamt eller som komplement till den vanliga intensivvårdsbehandlingen och kirurgiska behandlingen?
• Ska vi i vissa fall vänta med kirurgisk behandling tills regenerationsproceduren samtidigt kan sättas i gång i ett senare skede, och vilken är i så fall den adekvata tidpunkten för regenerationsåtgärderna?
• Kan vår nuvarande kunskap om de patofysiologiska processerna indikera när det är bäst att påbörja en regenerationsbehandling, och vilka är de optimala starttiderna för varje typ av behandling?
Etiska och juridiska frågeställningar måste besvaras samtidigt med den medicinska utvecklingen som, åtminstone avseende stamcellerna, går mycket fort. Tankarna kring behandling av den ryggmärgsskadade patienten kan lätt sväva ut i olika science fiction-modeller. Den kunskap som finns idag, som ett resultat av forskningen kring neuroprotektion och regeneration, har tyvärr gett endast marginell effekt i vården av den enskilde patienten.
Med dagens kunskap har vi fortfarande inte nått vårt mål att etablera en fulländad behandling som återger patienten åtminstone delar av förlorad neurologisk funktion. Vår kunskap är dock utomordentligt stor jämfört med för ett par decennier sedan, och en extrapolering framåt i tiden inger trots allt hopp om att ytterligare pusselbitar ska kunna adderas för att besvara en av medicinens mest utmanande frågeställningar; hur skadad alternativt avskuren vävnad i det centrala nervsystemet kan återfödas.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.