Sammanfattat
Vår ökade erfarenhet av kirurgisk behandling av sena komplikationer efter ryggmärgsskada, benämnd »rehabilitativ neurokirurgi«, medför att patienterna idag kan erbjudas ett flertal olika kirurgiska behandlingar vid smärta och spasticitet, och vid ett tillstånd som benämns posttraumatisk myelopati.
Med posttraumatisk myelopati menas en symtombild som karaktäriseras av tilltagande bortfall av motorisk och sensorisk funktion, smärtproblematik, ökad spasticitet, Horners syndrom och ökade besvär med autonom dysreflexi och svettningar.
Här presenteras olika kirurgiska alternativ för att mildra effekten av besvär som ytterligare sänker livskvaliteten hos redan hårt drabbade patienter.
Funktionsinskränkningen efter en ryggmärgsskada innebär allt från lätta rörelsehandikapp till ett komplett bortfall av motorisk funktion, sensibilitet och autonoma funktioner nedanför skadenivån. Endast en mindre del av de ryggmärgsskadade patienterna är tetraplegiska, men även denna patientgrupp har i regel viss kvarvarande funktion i armarna. Det är enbart ett fåtal individer som drabbas av en så hög skada i halsryggmärgen att all funktion i armar och ben slås ut. Det finns därför, teoretiskt sett, möjligheter till ytterligare försämring hos i princip samtliga ryggmärgsskadade patienter. Det neurologiska funktionsbortfallet efter en skada mot ryggmärgen är således inte statiskt. Tilltagande bortfall av motorisk och sensorisk funktion, smärtproblematik och ökad spasticitet är vanliga och besvärande symtom som påtagligt sänker livskvaliteten hos redan hårt drabbade patienter.
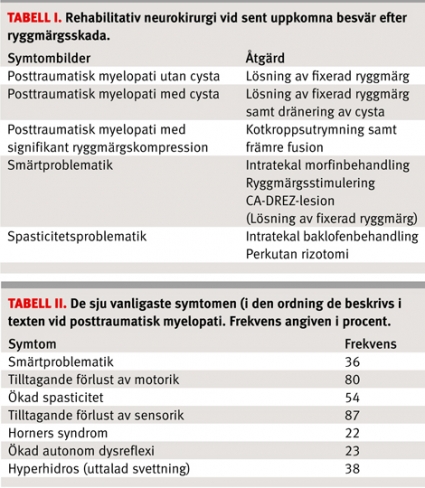
Vår ökade erfarenhet av kirurgisk behandling av sena komplikationer efter ryggmärgsskada, »rehabilitativ neurokirurgi«, gör att patienter idag kan erbjudas ett flertal olika kirurgiska behandlingar vid smärta och spasticitet och vid ett tillstånd benämnt posttraumatisk myelopati (ryggmärgssjukdom efter trauma) (Tabell I). En mer utförlig sammanfattning av ämnesområdet presenteras i referens [1]. Där ingår ett utförligt bildmaterial som ytterligare ökar förståelsen för de kirurgiska åtgärderna.
Posttraumatisk myelopati
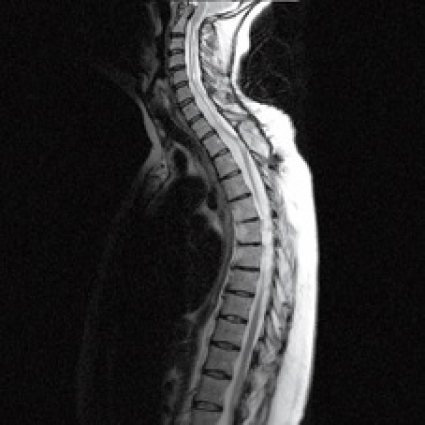
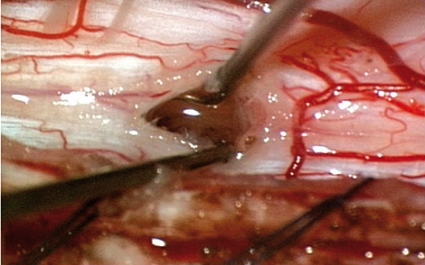
Vid posttraumatisk myelopati tillkommer nya symtom som läggs till de bortfall som redan tidigare uppstått i anslutning till traumat. I en artikel av deskriptiv karaktär, skriven av Edgar och Quail [2], redovisas författarnas erfarenheter av 600 fall samlade under en lång period. Karaktäristiskt för posttraumatisk myelopati är att besvären gradvis tilltar i svårighetsgrad över tiden. Symtombilden, eller diagnosen, benämns därför progressiv posttraumatisk myelopati (PPM). De vanligaste orsakerna till PPM är ärrbildning (araknoidit) i anslutning till skadelokalisationen i ryggmärgen (Figur 1 och 2) eller kvarvarande kompression av ryggmärgen orsakad av en tidigare frakturerad kotkropp.
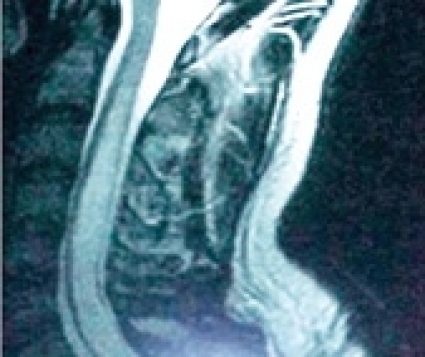
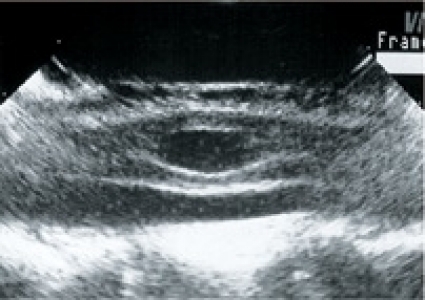
Patofysiologi. Enighet råder om att en ärrbildning uppstår kring ryggmärgen i skadenivån (Figur 2). Ryggmärgen fjättras till durasäckens insida via den bildade ärrkakan, och likvorflödet i subaraknoidalrummet blockeras. Ärrkakan är en förutsättning för att en initial mikrocysta ska kunna expandera till en flera decimeter lång cysta, som kan uppta stora delar av ryggmärgens diameter och på så sätt utöva ett tryck mot den omgivande ryggmärgen (Figur 3). Vad gäller patienterna med PPM utan cystbildning spekuleras det över om den fjättrade ryggmärgen utsätts för traktion (drag eller töjning) vid påfrestningar på kotpelaren.
Symtom. PPM kan debutera upp till flera decennier efter ett trauma. Symtomen beskrivs av de flesta patienter som långsamt tilltagande i intensitet. De sju kardinalsymtom som förekommer vid PPM återges i Tabell II och är hämtade ur referens 2. I detta manuskript framgår det att 75 procent av patienterna uppvisade två till fyra av de sju symtomen vid operationstillfället.
Smärtan vid PPM beskrivs som en antingen nociceptiv (träningsvärksliknande) eller neuropatisk smärta lokaliserad till i och ovanför skadenivån, och även nedanför skadenivån hos den inkomplett skadade patienten.
Den motoriska försämringen sker ovanför skadenivån hos den komplett skadade patienten. Den inkomplett skadade patienten kan iaktta en liknande försämring ovanför skadenivån, men även kraften i till exempel bålmuskulaturen (stabiliserar vid sittande) och/eller nedre extremiteterna kan försämras. Det extrema patientfallet kan illustreras med en ursprungsskada i konusregionen. En långsträckt intramedullär cysta som når upp till halsryggmärgen ger upphov till en försämrad handfunktion som första symtom, orsakad av den mest kraniala delen av cystan.
Ökande spasticitet kan ha många andra orsaker än myelopati, till exempel smärta och infektioner, och betraktas som ett symtom på PPM först när andra orsaker uteslutits.
Försämrad sensorisk funktion kan vara av olika karaktär. Vanligast är störningar i smärt- och temperaturuppfattningen (dissocierad känselförlust), men en förlust av till exempel känsel i tum–pekfingergreppet kan vara det första en rullstolsburen patient observerar. Bortfall av tum–pekfingergreppet får mycket stora konsekvenser i det dagliga livet eftersom finmotoriken försämras kraftigt trots en intakt motorisk förmåga.
Symtom som Horners syndrom, ökad autonom dysreflexi och hyperhidros stärker diagnosen PPM, men avsaknad av dessa symtom utesluter inte diagnosen.
Utredning. I den preoperativa utredningen ingår en radiologisk, neurofysiologisk och neurologisk bedömning, liksom utvärdering av livskvalitetsfaktorer. Operationsbeslutet grundar sig dock i första hand på patientens egen sjukhistoria, övriga utredningar tjänar som komplement. Till exempel utesluts inte förekomst av fjättring även om fjättringsliknande förändringar inte upptäcks vid en magnetkameraundersökning. Förekomst av intramedullära cystor behöver å andra sidan inte indikera ett behov av kirurgisk behandling.
Differentialdiagnoser som degenerativ kotpelarsjukdom, kvarvarande instabilitet och tilltagande kyfos i det skadade rörelsesegmentet, tumörer av olika slag, perifera neuropatier samt inflammatoriska och metabola tillstånd kan till viss del påminna om PPM.
Kirurgisk behandling vid PPM
Syftet med det kirurgiska ingreppet är att avbryta den patofysiologiska process som grundar sig på fjättring av ryggmärgen mot durasäckens insida [2, 3]. Målsättningen med operationen är inte primärt att minska graden av besvär utan att få symtombilden att förbli på samma nivå som före ingreppet, det vill säga att stoppa en progress av symtomen. Sker det en förbättring får detta betraktas som en bonuseffekt av ingreppet.
Subjektiv och objektiv försämring av motorisk och sensorisk funktion är de vanligaste indikationerna för ett operativt ingrepp (Fakta 1). En tilltagande svår träningsvärksliknande smärta kan också utgöra indikation för operation. Tidpunkten då den neuropatiska smärtan debuterar är av betydelse för val av operationsmetod. Om det sker i nära anslutning till olyckan väljs CA-DREZ-lesion (se vidare under rubriken CA-DREZ-lesion), men vid senare debut väljs lösning av fixerad ryggmärg. Detta beror på att mekanismerna bakom smärtan är olika i dessa fall. Vid ökad spasticitet, ökad autonom dysreflexi, hyperhidros eller Horners syndrom som enda symtom på PPM föreligger inte indikation för operation.
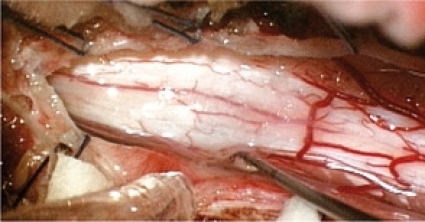
Tillvägagångssätt. Vid ingreppet öppnas durasäcken i längsriktningen varefter ärrkakan lossas så att ryggmärgen inte längre sitter fast. Ryggmärgen återfår då sitt normala läge i spinalkanalen, och likvor kan åter flöda förbi det tidigare passagehindret. Med ultraljud kan förekomst av fjättring/ärrvävnad och cystor diagnostiseras under ingreppet (Figur 4). Om patienten har en intramedullär cysta väljer de flesta operatörer att öppna ryggmärgen i medellinjen (myelotomi; Figur 5) och sedan applicera en dränagekateter. En så kallad duraplastik utförs för att förhindra återfjättring, det vill säga att ryggmärgen åter växer fast i durasäcken. När duratransplantatet sys på plats strävar man efter att få det hela »vattentätt«. Om blod återsamlas innanför duraplastiken uppstår förutsättningar för en återfjättring. Risken ökar då för att patienten, efter en period av gott resultat av ingreppet, åter insjuknar med likartad symtombild.
Resultat. Den neurologiska försämringen avstannade hos samtliga 600 patienter som Edgar och Quail redogjort för [2]. Den försämrade motoriska och sensoriska funktionen, liksom den neuropatiska smärtan orsakad av PPM, förbättrades i 87 procent av de opererade fallen om ingreppet utfördes inom tre månader efter symtomdebuten. Resultaten försämrades vid längre tids sjukdomshistoria. Liknande goda resultat är presenterade av andra författare [3].
Kirurgisk behandling vid kvarvarande mekanisk kompression
Om orsaken till PPM anses vara en mekanisk kompression av ryggmärgen orsakad av en tidigare frakturerad kotkropp, tas kotkroppen bort vid det operativa ingreppet. Benvävnaden ersätts vanligtvis med ben från höftbenskammen innan en främre fusion sker med platta och skruvar.
Kirurgisk (invasiv) smärtbehandling
Efter våld mot ryggmärgen uppstår skador på de nociceptiva neuronen i bakhornen, och en ektopisk stimulering av dessa kan ske från dorsalrotsganglierna. Det innebär att ett tillstånd av hyperexcitabilitet kan uppstå, och patienterna kan utveckla ett svårt tillstånd av neuropatisk smärta. I vissa fall är konventionell fysikalisk och farmakologisk smärtterapi otillräcklig, och någon form av invasiv terapi kan då vara ett alternativ.
Intratekal morfinbehandling
Opioidbehandling (morfin) av neuropatisk smärta har sin bakgrund i att olika opioidtransmittorer och opioidreceptorer har påträffats i dorsalhornsneuronen. Morfinet utövar sin analgetiska effekt genom att binda sig till vissa receptorer. Den analgetiska effekten uppnås genom blockering av transmissionen i synapsen mellan primära afferenter och andra ordningens neuron.
Tillvägagångssätt. Med intratekal administration av ett läkemedel menas att en kateter placeras i likvorrummet mellan araknoidean och ryggmärgen, det vill säga subaraknoidalt. Katetern kopplas sedan till en infusionspump som placerats i bukens fettlager, och mängden farmaka som ges till patienten kan regleras utifrån via en fjärrkontroll. Fördelen med intratekal administration är bland annat att flertalet biverkningar kan undvikas eftersom läkemedlet inte ansamlas i hjärnan. Den terapeutiska effekten av 1 mg morfin intratekalt motsvarar 150 mg av peroralt intag. En vanlig dygnsmängd morfin som ges intratekalt varierar mellan 1 och 20 mg.
Den enda egentliga nackdelen med intratekal morfinbehandling är toleransutvecklingen. Med »drogsemester«, uppehåll med terapin under vissa perioder, eller genom att addera farmaka som klonidin (Catapresan) till morfinlösningen hoppas man kunna fördröja toleransutvecklingen.
Komplikationer som granulombildning och annat katetertrassel, exempelvis meningit och myelit, har rapporterats. Till detta adderas övergående initiala biverkningar som urinretention och klåda, och bestående biverkan i form av förstoppning.
Ryggmärgsstimulering
Även om huvudindikationen för ryggmärgsstimulering är svår neuropatisk smärta av perifert ursprung har man vid enstaka tillfällen gjort försök med elektrisk ryggmärgsstimulering (spinal cord stimulation, SCS) som behandling vid central smärta efter ryggmärgsskada. Effekten av SCS är relativt nedslående vad gäller den centralt utlösta smärtan. Vid smärta av såväl centralt som perifert ursprung hos till exempel patienter med en inkomplett skada kan metoden dock ha en viss effekt.
Tillvägagångssätt. En baksträngsstimulator anläggs vanligtvis i två etapper. Vid ingrepp nummer ett appliceras en elektrod på baksidan av durasäcken i epiduralrummet, via en perkutan teknik. Elektrodkabeln kopplas därefter till en extern pulsgenerator. Patienten och den behandlande läkaren kan då aktivera stimulatorn och testa om elektrisk stimulering av baksträngarna lindrar smärtan. Om behandlingen ger smärtlindring kan stimulatorn implanteras subkutant och regleras utifrån med en fjärrkontroll.
CA-DREZ-lesion
Generellt sett är patienter med deafferentieringsmärta de bästa kandidaterna för datorstyrd lesion av dorsalrotsinträdet, CA-DREZ-lesion (computer assisted dorsal root entry zone lesion) [4]. Med deafferenteringssmärta menas den smärta som uppstått i afferenta banor då dessa drabbats av en mekanisk skada eller av någon annan anledning inte fungerar normalt. Indikationen för ingreppet är neuropatisk smärta av svidande, brännande, huggande eller elektrisk karaktär, helst med en bandformad (segmentell) utbredning i skadenivån, men även smärta som strålar från skadenivån och nedåt. Denna smärta ska ha förekommit i princip ända från skadetillfället och vara av en så hög intensitet att ingen annan terapi kunnat mildra smärtan.
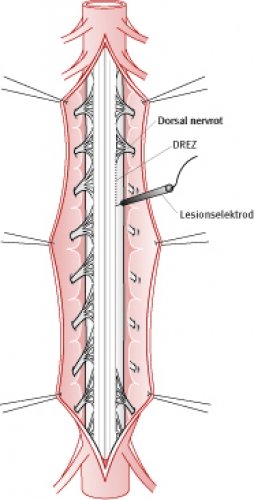
CA-DREZ-lesion är en form av destruktiv (vävnadsskadande) kirurgi som innebär att man genom termokoagulation, som kan liknas vid en form av diatermi, orsakar en brännskada i bakhornet (Figur 6). I princip innebär tekniken att elektrisk ström alstras via en impulsgenerator tills man uppnår en förutbestämd värmenivå i lesionselektrodens spets. Det intressanta är att denna elektrod även kan mäta antalet aktionspotentialer i vävnaden. Den elektrokemiska aktivitet som registreras är ett mått på hyperexcitabiliteten i vävnaden. Teoretiskt innebär lokaliseringen av de hyperaktiva områdena att lesionen kan riktas specifikt mot dessa segment av ryggmärgen.
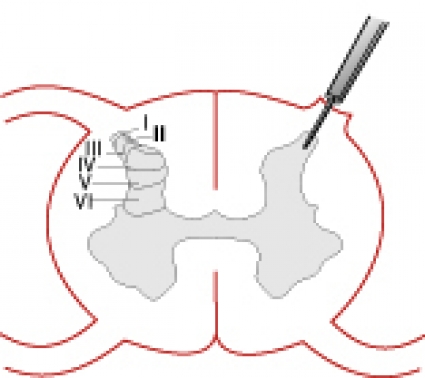
Tillvägagångssätt. Det operativa ingreppet inleds med lösning av den fixerade ryggmärgen. Därefter friprepareras DREZ bilateralt (Figur 6). När DREZ identifierats förs lesionselektroden (0,25 mm diameter) in 1,5 mm i vävnaden. Om registreringen visar en elektrokemisk hyperaktivitet kopplas elektroderna till en lesionsgenerator och lesionen utförs. Det innebär att ett mycket stort antal lesioner utförs på båda sidor eftersom lederingen kan omfatta en sträcka på 10–15 cm på vardera sidan motsvarande fem segment av ryggmärgen.
Resultat. Ur neurokirurgisk synvinkel är CA-DREZ-lesion fortfarande en metod som kan utvecklas. Mycket intressanta är resultaten av så kallad mapping. Mapping innebär här att man försöker korrelera områden på kroppen med neuropatisk smärta till motsvarande ryggmärgsnivå. Detta är av stor vikt bland annat mot bakgrund av att en av komplikationerna vid CA-DREZ-lesion är förlust av motorik i de lederade nivåerna. Just risken för motorikförlust innebär att man normalt inte utför CA-DREZ-lesion vid skador över Th 5. Fem nivåers ledering ovanför till exempel Th 3 innebär en risk för förlust av viss motorisk handfunktion.
Kirurgisk (invasiv) spasticitetsbehandling
Spasticitet ingår som tidigare nämnts som ett delmoment i symtombilden vid PPM. Isolerad spasticitet utgör dock inte indikation för lösning av fixerad ryggmärg. Vid utebliven effekt av peroralt baklofen och andra konservativa åtgärder finns ytterligare två behandlingsalternativ: infusionspump och perkutan rizotomi.
Intratekal baklofenbehandling
Baklofen är ett derivat av gamma-mino-smörsyra (GABA) och fungerar som en presynaptisk hämmare av spinala reflexer, sannolikt genom stimulering av GABA-b-receptorer. Fördelen med intratekal behandling är att koncentrationen av ämnet i likvor blir hög och att avståndet till GABA-b-receptorerna i ryggmärgen är kort. Efter en intratekal administration av baklofen lumbalt minskar koncentrationen i likvor till 25 procent cervikalt och intrakraniellt i förhållande till lumbalregionen. Fördelen med den minskade koncentrationen högre upp i spinalkanalen är att de cerebrala biverkningar som den perorala behandlingen ger upphov till i princip elimineras.
Indikationen för intratekal tillförsel av baklofen är tonusökning som ger upphov till rörelseinskränkning, blåspåverkan och/eller smärta där peroral behandling gett otillräcklig effekt och/eller oacceptabla biverkningar.
Tillvägagångssätt. Efter att den kliniska indikationen för intratekal behandling med baklofen ställts genomgår patienten ett tvåstegsförfarande.
I steg ett får patienten en intratekal testdos på 25 till 50 µg baklofen, varefter spasticitet, flexorautomatismer, rigiditet och blåsfunktion utvärderas. Om testdosen ger positiv effekt erbjuds patienten steg 2; implantation av subkutan doseringspump för kontinuerlig intratekal tillförsel av baklofen. Baklofen fylls på i pumpens reservoar, och pumpen startas. En dygnsmängd på cirka 200 (my)g är vanlig. Patienten övervakas ett dygn efter applicering av testdoser vid steg ett, och vid en justering av dosen efter att pumpen implanterats på mer än 5 procent. Övervakningstiden uppgår till fem dygn i samband med pumpimplantation, på grund av risken för allvarliga komplikationer av för stor infusion av baklofen, till exempel medvetandesänkning och andningsstillestånd.
Komplikationer i det långa perspektivet är kontinuitetsavbrott i katetern och enstaka fall av ortostatisk hypotension, erektionsförlust och toleransutveckling.
Perkutan rizotomi
Indikationen för detta ingrepp är svår tonusökning i muskulaturen abdominellt samt i nedre extremiteterna.
Tillvägagångssätt. Vid perkutan rizotomi förs en lesionselektrod in 6 cm lateralt om medellinjen och riktas mot de aktuella transversalutskotten, varefter man söker upp intervertebralforamina och lederar nervrötterna.
Perkutan rizotomi görs oftast dubbelsidigt från Th 12-roten till och med L 5-roten. S 1 – S 4-rötterna sparas. Därefter avslutas ingreppet med att ischiasnerverna lederas. Effekten av ingreppet kvarstår vanligtvis upp till något år. Därefter görs inte helt sällan kompletteringar med nya lesioner.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.