Sammanfattat
Vi har i Sverige en betydande transplantationsverksamhet med goda överlevnadsresultat.
Allt fler patienter med fungerande transplantat kommer därför att ses mer frekvent på olika vårdinrättningar.
När man möter en transplanterad patient är det viktigt att tänka på att den immunsuppressiva behandlingen inte får avbrytas, att många immunsuppressiva läkemedel interagerar med andra läkemedel, att infektioner är vanliga och att grundsjukdomen kan återkomma.
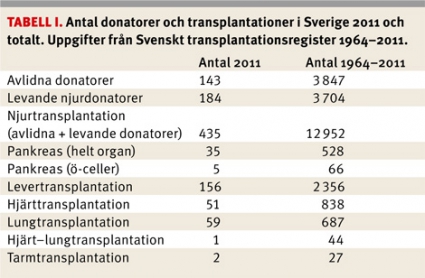
Denna artikel är avsedd att vara en hjälp för de läkare som möter transplanterade patienter på akutmottagningar och vårdcentraler. Med allt bättre resultat blir de transplanterade patienterna allt fler. I Sverige har sedan 1964 totalt nära 13 000 patienter njurtransplanterats (Tabell I), och av dessa lever i dag ungefär 4 800 med fungerande transplantat. Nästan lika många har transplanterats med andra organ. Det innebär att de flesta läkare någon gång kommer att möta någon av dessa patienter, oftast av helt andra skäl än transplantationen.
För dessa vårdgivare är det viktigt att se till att patienterna behåller en adekvat immunsuppression för att förhindra avstötning, även om patienterna behöver medicinsk eller kirurgisk behandling för en annan sjukdom. Vidare behöver alla vårdgivare vara medvetna om att ovanliga sjukdomar kan vara vanligare hos transplanterade patienter liksom att vanliga sjukdomar på grund av immunsuppressionen kan ha en något annorlunda klinisk presentation. Risken för interaktion med patienternas immunsuppressiva läkemedel kräver särskild uppmärksamhet när nya läkemedel tillkommer eller gamla tas bort. Tveka aldrig att kontakta patientens transplantationsenhet för frågor och råd!
Njurar
Njurtransplantation har utförts i Sverige sedan 1964, och antalet utförda transplantationer ökade successivt fram till slutet av 1980-talet, varefter transplantationsfrekvensen har uppgått till 300–400 per år. Under 2011 utfördes 435 njurtransplantationer, varav 184 med njure från levande donator. De vanligaste orsakerna till terapikrävande njursvikt är glomerulonefrit, diabetesnefropati och cystnjuresjukdom. Överlevnaden, såväl för den transplanterade patienten som för transplantatet, har successivt förbättrats. Vi har i Sverige i dag ca 8 500 patienter med kronisk njursvikt som har någon form av aktiv behandling. Drygt hälften, ca 4 800, lever med ett fungerande njurtransplantat, dvs är inte i behov av dialys.
Nyligen publicerad statistik från Svenskt njurregister (SNR) visar att 90 procent av transplantat från avlidna (Figur 1) och 95 procent av transplantat från levande donatorer fortfarande fungerar efter fem år (Figur 2). Patientöverlevnaden vid fem års uppföljning är ca 90 procent för patienter med njure från avliden donator och ca 97 procent för dem som erhållit njure från levande givare [1], vilket delvis förklaras av att den senare gruppen har en lägre genomsnittsålder (45 år) än den förra (59 år) [2].
Vi bör i Sverige kunna räkna med att hälften av de njurtransplanterade patienterna vid 20 års uppföljning lever med fungerande transplantat. Mortaliteten hos patienter med fungerande njurtransplantat har varit tämligen stationär, cirka 2,4 procent årligen. De vanligaste dödsorsakerna har varit hjärtsjukdom, malignitet och infektion.
Lever
I Sverige genomfördes den första levertransplantationen 1984, och vid 2011 års utgång hade 2 356 levertransplantationer utförts (Tabell I). Transplantationsfrekvensen har de senaste åren uppgått till ca 150 per år, varav 3–5 procent genomförts med lever från levande givare. Andelen barn som transplanteras utgör ca 5 procent av samtliga levertransplantationer, där gallvägsatresi är den vanligaste diagnosen. Hos vuxna är indikationerna framför allt primär skleroserande kolangit, hepatocellulär cancer, levercirros till följd av alkohol eller hepatit C samt akut leversvikt [3]. Resultaten har generellt förbättrats men är beroende av diagnosen (Figur 3). I dag ligger ett- och femårsöverlevnaden för patienter med kroniska leversjukdomar på omkring 90 respektive 80 procent [3].
Mortaliteten efter levertransplantation är vanligen orsakad av komplikationer till immunsuppressiv behandling (≈65 procent) och utgörs av malignitet, infektion, kardiovaskulär sjukdom och njursvikt. Endast ca 25 procent av patienterna avlider till följd av transplantatsvikt [4-6]. Det är därför viktigt att optimera immunsuppressionen utifrån den enskilde patientens behov där underliggande leversjukdom, tid som förflutit sedan operationen, rejektionstendens och infektionskomplikationer har betydelse. Mortalitet vid transplantatsvikt är vanligen en följd av recidiv av leversjukdomen, kronisk rejektion eller kärl- eller gallvägskomplikationer [7-9].
För mer information rörande levertransplanterade patienter, se nyligen framtagna nationella riktlinjer för uppföljning av levertransplanterade ‹www.svenskgastroenterologi.se›.
Hjärta
Den första hjärttransplantationen i Sverige utfördes 1984. Fram till utgången av år 2011 hade 838 hjärttransplantationer utförts i Sverige (Tabell I). Prognosen är god vid internationell jämförelse. Se mer i artikeln om hjärttransplantationer av Kornhall.
Lungor
Lungtransplantationer har utförts i Sverige sedan 1990, och till och med 2011 uppgår antalet till 687 (Tabell I). Liksom för hjärttransplantationerna har antalet ökat under senare år. Sedan 2008 har det utförts fler än 50 lungtransplantationer i Sverige per år. De vanligaste diagnoserna som leder till en lungtransplantation är kroniskt obstruktiv lungsjukdom (KOL) med eller utan bidragande alfa-1-antitrypsinbrist, cystisk fibros, lungfibros och pulmonell hypertension [10]. Aktuell statistik visar att överlevnaden för de lungtransplanterade i Lund är 88 procent vid ett års, 65 procent vid fem års och 49 procent vid tio års uppföljning.
Uppföljning
Under tiden närmast efter transplantationen har patienten naturligt en nära kontakt med sitt transplantationscentrum. Den fortsatta uppföljningen är sedan något olika beroende på både geografiska skäl och vilket organ som är transplanterat. Då transplantationsverksamheten i Sverige är betydande och överlevnadsresultaten goda kan vi förvänta oss ett allt större antal patienter med fungerande transplantat.
Transplanterade patienter kommer således att ses mer frekvent på olika vårdinrättningar, vilket betyder att också kliniker utanför transplantationscentra kommer att möta dessa patienter och de särskilda problem de presenterar.
Läkemedelsinteraktioner
Det finns ett antal kliniskt viktiga interaktioner att ta hänsyn till vid varje nyinsättning, dosändring eller utsättning av läkemedel hos transplanterade patienter.
En mycket allvarlig interaktion är den mellan allopurinol och azatioprin, som kan leda till livshotande benmärgshämning. En vanligare interaktion är den mellan makrolidantibiotika som erytromycin och kalcineurinhämmare (CNI), dvs ciklosporin och takrolimus, där även en korttidskur med erytromycin kan höja CNI-koncentrationen kraftigt och leda till njurpåverkan. Andra kliniskt vanliga interaktioner finns mellan vissa svampmedel, framför allt ketokonazol, och flera olika immunsuppressiva läkemedel. Kalciumflödeshämmarna diltiazem och verapamil höjer CNI-koncentrationen, vilket även grapefrukt gör. Vissa antiepileptika liksom johannesört sänker däremot CNI-halterna. Generellt är interaktioner mellan naturläkemedel och immunsuppressiva läkemedel mycket dåligt undersökta, varför naturläkemedel bör undvikas.
Då interaktionerna är många måste man vid varje ändring av läkemedelsordinationen kontrollera möjligheten av eventuella interaktioner noggrant! Observera också att CNI kan öka blodkoncentrationerna av andra läkemedel, t ex statiner.
Infektioner
Infektioner efter transplantation är vanliga, och agens varierar beroende på när i efterförloppet infektionen uppstår. Tidigt (<4 veckor) dominerar bakteriella infektioner, som ofta är relaterade till det kirurgiska ingreppet. Under de följande 1–6 månaderna är det i stället opportunistiska infektioner såsom polyomavirus (t ex BK-virus), cytomegalovirus (CMV) eller Pneumocystis jiroveci som dominerar. Efter sex månader skiljer sig infektionspanoramat föga från det i normalbefolkningen och utgörs huvudsakligen av samhällsförvärvade infektioner såsom urinvägs- och luftvägsinfektioner samt reaktivering av CMV eller andra virala agens [11].
CMV-reaktivering kan ge olika symtombilder med allt från en subklinisk infektion till subfebrilitet med eventuell benmärgshämning (CMV-syndrom) eller svår organmanifestation (t ex cystit, hepatit, kolit, pneumonit eller encefalit) med påverkat allmäntillstånd. Det är en fördel om dessa fall kan handläggas på infektionsklinik med transplantationserfarenhet. Diagnostiken baseras på att påvisa virus i plasma med PCR-teknik. Negativ plasma-PCR utesluter inte helt möjligheten av en CMV-infektion då en lokaliserad vävnadsinfektion kan föreligga, vilket kräver vävnadsprov för diagnos.
Långdragna eller återkommande problem med svampinfektioner eller med virusinducerade hud- eller slemhinnebesvär som vårtor, afte eller bältros väcker frågan om det går att minska det immunsuppressiva trycket eller ändra kombinationen av läkemedel och bör diskuteras med den läkare som sköter uppföljningen efter transplantationen.
Det är viktigt att se över patientens vaccinationsstatus och vaccinera vid behov, men observera att vacciner med levande agens är kontraindicerade efter transplantation. Generellt måste man tänka på att svarsfrekvensen vid en vaccination är lägre än hos icke-immunsupprimerade.
Tänk därför på att också vaccinera anhöriga och vårdpersonal mot säsongsinfluensan!Kardiovaskulära komplikationer
Risken för kardiovaskulära komplikationer är flerfaldigt högre hos transplanterade patienter än i normalpopulationen. Hos njurtransplanterade bidrar den bakomliggande uremin/njursjukdomen, men risken är trots allt lägre för njurtransplanterade patienter än för dialyspatienter. Hypertoni är vanligt, och risken för behandlingskrävande sådan ökar med sjunkande glomerulär filtrationshastighet (GFR). Den immunsuppressiva medicineringen kan bidra till hypertonin, särskilt om plasmanivån av CNI är hög. För samtliga transplanterade patienter gäller det att minimera de traditionella riskfaktorerna, såsom rökning, övervikt, hypertoni, hyperlipidemi och diabetes mellitus. Njursvikt kan ses till följd av biverkningar av CNI i form av renal vasokonstriktion och kronisk toxicitet. Risken för njurskada ökar om CNI-koncentrationen i blod är hög och behandlingsdurationen lång [12, 13].Diabetes mellitus
Incidensen av diabetes mellitus efter transplantation (kallad »new onset diabetes after transplantation«, NODAT) är hög och ses hos upp till 30 procent av patienterna. Risken är högst under de första månaderna efter transplantationen. Riskfaktorer för att utveckla NODAT är immunsuppressiv behandling (CNI, kortison, mTOR-hämmare), hepatit C jämte sedvanliga riskfaktorer för diabetes, såsom fetma [14]. Orsaken till NODAT är antingen ökad insulinresistens (fetma, hepatit C, steroider eller mTOR-hämmare) eller minskad insulinproduktion (takrolimus) [15].Fetma
Fetma är en mycket vanlig komplikation efter organtransplantation. Orsakerna är multifaktoriella, delvis okända och spänner över allt från inaktivitet och god aptit till biverkningar av den immunsuppressiva behandlingen, främst av kortisonet.Skelettproblem
Nedsatt bentäthet, fraktur och skelettsmärta är vanligt förekommande hos transplanterade. Riskfaktorerna för osteoporos skiljer sig inte från de traditionella utan utgörs av t ex rökning, hög ålder och långvarig steroidbehandling. Patienter med njursvikt kan dessutom utveckla osteodystrofi sekundärt till hyperparatyreoidism. Förutom sedvanliga åtgärder, som god kosthållning inklusive adekvat kalktillförsel och fysisk aktivitet, kan behandling med D-vitamin och bisfosfonater vara aktuell. Trots att studier visat effekt av bisfosfonater för att öka skelettdensiteten så saknas fortfarande evidens gällande reducerad frakturrisk och mortalitet.
En plötsligt påkommen invalidiserande smärta i knä eller höft kan vara orsakad av osteonekros relaterad till behandling med kortikosteroider, CNI eller mTOR-hämmare [16]. Vanlig slätröntgen ger i det tidiga skedet negativt resultat, medan magnetkameraundersökning ofta ger diagnosen. Avlastning och ortopedbedömning rekommenderas.Maligniteter
Det är väl känt att tung och långvarig immunsuppression medför risk för maligniteter. Framför allt finns en ökad incidens av basaliom och skivepitelcancer i huden samt lymfom, men även andra tumörer är överrepresenterade; se artikeln om maligniteter efter organtransplantation.Recidiv av grundsjukdomen i transplantatet
Vad gäller njurtransplantation finns dokumentation om att framför allt IgA-nefropati, fokal segmentell glomeruloskleros, membranös nefropati, membranoproliferativ glomerulonefrit och diabetesnefropati tenderar att recidivera i transplantatet. Vid de regelbundna kontrollerna hos transplantationsnefrolog ska detta beaktas vid t ex tillkomst eller försämring av proteinuri, hematuri eller njurfunktionsnedsättning.
De flesta leversjukdomar kan recidivera. Recidivfrekvensen för primär skleroserande kolangit är ca 20 procent, men diagnosen kan vara svår att ställa då kronisk rejektion och trombos eller stenos i leverartären kan ge liknande gallvägsförändringar. Patienter med primär skleroserande kolangit och inflammatorisk tarmsjukdom (IBD) rekommenderas att genomgå årliga koloskopier med multipla biopsier då den ökade risken för kolorektal cancer kvarstår efter levertransplantationen [17].
Alla patienter med hepatit C och viremi vid transplantationen får recidiv av hepatit C-virusinfektionen med risk för leverskada och cirrosutveckling (20–30 procent inom fem år) [18]. Protokollbiopsier bör utföras sex och tolv månader efter levertransplantationen samt därefter årligen och vid klinisk indikation för att upptäcka behandlingskrävande hepatitrecidiv. Behandlingen motsvarar i dag den som ges till icke-transplanterade patienter. Efter levertransplantation till följd av hepatit B-virus (HBV) ska livslång antiviral profylax ges med regelbunden kontroll av HBV-DNA-nivåer samt serologi.
Risken för återfall i hepatocellulär cancer efter levertransplantation är i storleksordningen 10–20 procent [19]. Resektion av ett fokalt recidiv kan medföra en femårsöverlevnad på närmare 50 procent [19]. Detta är i dag argumentet för screening för recidiv av hepatocellulär cancer var sjätte månad de första fem åren efter levertransplantaton med trifasisk DT, MRT med leverspecifik kontrast eller ultraljud med kontrast. Lämpligen används samma modalitet vid varje tillfälle för att underlätta jämförelse.
Patienter som levertransplanterats på grund av alkoholcirros riskerar att återfalla i alkoholbruk, men skadligt bruk är ovanligt (10–15 procent) [20]. Inför levertransplantation bedöms patienterna av beroendeläkare, och en plan för uppföljning och behandling av alkoholberoendet/alkoholmissbruket efter operationen sätts upp. För kontroll av nykterhet rekommenderas undersökning av blod-PEth (fosfatidyletanol).Sexualfunktion – graviditet – amning
Fertiliteten är oftast nedsatt vid svår organsjukdom men ökar efter transplantationen. Vid graviditetsönskemål är det viktigt att den transplanterade kvinnan tar upp detta med sin transplantationsläkare innan hon försöker bli med barn. Då en transplanterad kvinna planerar graviditet måste immunsuppressionen anpassas och uppföljningen arrangeras i samarbete mellan transplantationsenheten och specialistmödravården. CNI tycks inte påverka fostret negativt, och azatioprin brukar betraktas som säkert. Mykofenolatmofetil är teratogent och strikt kontraindicerat vid graviditet, liksom de nyare mTOR-hämmarna, t ex everolimus och sirolimus.
Riskerna är ökade främst avseende prematuritet, hypertoni, proteinuri och eklampsi. Vid amning måste man observera att vissa läkemedel går ut i modersmjölken och kan påverka barnet. CNI passerar över till modersmjölken, men det är okänt om detta påverkar barnet negativt. Amningsrekommendationerna varierar i dag mellan transplantationscentra. För transplanterade män som önskar bli fäder är situationen oftast enklare, och någon särskild hänsyn behöver inte tas.Den åldrade patienten med ett transplantat
Vi kommer att möta allt fler och allt äldre patienter med organtransplantat. Omhändertagandet av äldre transplanterade skiljer sig inte från det av yngre, men man bör tänka på att en åldrad person ofta har sänkt GFR och lägre rejektionsbenägenhet. Äldre patienter har vanligen mindre muskelmassa, varför ett normalt plasmakreatininvärde kan ses trots sänkt GFR. Därför är det viktigt att regelbundet följa GFR. De mest exakta undersökningarna för att mäta GFR är 51Cr-EDTA-clearance eller johexolclearance. Ett enklare men mindre precist test är att estimera GFR (eGFR) utifrån kreatininvärdet,
Vid dosering av läkemedel, inklusive immunsuppressiva sådana, bör man ta hänsyn till både GFR och en potentiellt lägre läkemedelsmetabolism i levern.