HPV-relaterad anal och orofaryngeal cancer ökar hos män.
Riskgrupper inkluderar män som har sex med män, transpersoner och personer som lever med hiv.
HPV-vaccination given upp till 26 års ålder är effektiv för att förebygga HPV och cancerförstadier bland män.
Folkhälsomyndigheten bedömer att kompletterande vaccination (»catch up«-vaccination) av ovaccinerade män till och med 26 års ålder är kostnadseffektiv.
Vaccination av män skyddar även kvinnor genom minskad överföring av HPV.
Analcancerscreening av högriskgrupper rekommenderas internationellt, men svenska riktlinjer saknas.
Ökad vaccination och förbättrad screening är nödvändig för att minska bördan av HPV-relaterad cancer.
Humant papillomvirus (HPV) är den vanligaste sexuellt överförda infektionen i Sverige och globalt. Av mer än 200 HPV-genotyper står HPV 6 och 11 för 90 procent av alla kondylom (könsvårtor), medan minst 13 HPV-genotyper klassas som högrisktyper (onkogena) [1]. Till skillnad från vaccininducerade antikroppar ger antikroppar efter en HPV-infektion inte tillräckligt skydd mot nya infektioner av samma genotyp [2]. HPV-virusets förmåga att undvika immunförsvaret kan orsaka en persisterande HPV-infektion [1]. Flickor har erbjudits HPV-vaccination sedan 2012, vilket innebär att högrisk-HPV-infektion i princip försvunnit bland kvinnor upp till 24 år [3]. Pojkar började erbjudas HPV-vaccination först 2020. En persisterande infektion med högrisk-HPV kan leda till cancerutveckling, vilket hos män innefattar analcancer, peniscancer och orofaryngeal cancer (främst tonsiller och tungbas).
I juni publicerades en utredning från Folkhälsomyndigheten, på uppdrag av regeringen, där konklusionen var att det finns ett behov av att erbjuda kompletterande vaccination (»catch up«-vaccination) till ovaccinerade pojkar och män till och med 26 års ålder samt särskilda vaccinationsinsatser riktade mot ovaccinerade till och med 26 års ålder i riskgrupperna män som har sex med män (MSM), transpersoner och personer som lever med hiv [4]. Den 5 december 2024 kom Folkhälsomyndigheten med nya rekommendationer om vaccination mot HPV där personer upp till och med 26 års ålder nu rekommenderas vaccination.
Analcancer
Globalt diagnostiseras cirka 44 000 nya fall av analcancer per år, varav 30 procent bland män. En tydlig ökning av analcancer har identifierats i höginkomstländer, inklusive Sverige (Tabell 1). Orsakerna till detta är oklara, men en hypotes är ändrade sexualvanor. Ca 84 procent av alla analcancerfall är relaterade till HPV-infektion, och då främst typerna HPV 16 eller 18 (91 procent).
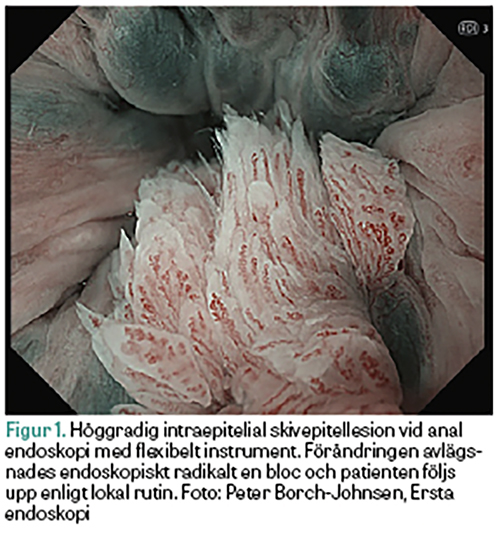
Förstadier till analcancer delas upp i låg- och höggradig intraepitelial skivepitellesion. Låggradig intraepitelial skivepitellesion motsvarar en övergående HPV-infektion och inkluderar kondylom och låggradiga cellförändringar. Höggradig intraepitelial skivepitellesion inkluderar måttlig till höggradig dysplasi, inklusive cancer in situ (Figur 1). Andra HPV-typer än HPV 16 (non-HPV 16) orsakar en stor andel av förstadier till analcancer, men merparten kommer inte att utvecklas till cancer. Alla förstadier till invasiv analcancer kan gå i regress.
Medianåldern vid analcancerdiagnos hos män är 65–70 år, och den vanligaste histologiska formen är skivepitelcancer [5]. Analcancer diagnostiseras ofta sent, då det inte finns någon rutin för analcancerscreening inom svensk sjukvård.
Analcancer behandlas vanligtvis med strålning och cytostatika, men ibland är kirurgi nödvändig. Behandlingen ger ofta påtagliga lokala dermatiter och tarmbesvär initialt och kan ge långsiktiga kroniska tarmproblem, miktionsproblem och sexuell dysfunktion. Femårsöverlevnaden vid tidigt upptäckt analcancer är 70–80 procent, vid lokalt avancerad cancer 60–70 procent och vid fjärrmetastasering 20 procent. Vid tidiga förstadier (låggradig intraepitelial skivepitellesion) rekommenderas exspektans, och höggradiga förändringar (höggradig intraepitelial skivepitellesion) behandlas med topikal behandling, alternativt lokal excision, eller destruktion med diatermi, laser eller kryobehandling.
Riskgrupper för analcancer bland män inkluderar personer som lever med hiv, MSM, transpersoner och personer med nedsatt immunförsvar efter organtransplantation. De viktigaste riskfaktorerna för förekomst av HPV analt är framför allt relaterade till antal sexualpartner samt graden av eventuell immunsuppression [6]. En metaanalys som inkluderade 64 studier och 29 900 män visade tydliga skillnader i prevalens av analt HPV 16 och andra högrisk-HPV mellan olika riskgrupper (Tabell 2).
MSM med hiv och transkvinnor med hiv lever med den högsta risken för både persisterande anal HPV-infektion, kondylom, förstadier till analcancer och analcancer. En svensk studie har visat att nedsatt immunförsvar vid hivdiagnos och dålig återhämtning av immunförsvaret trots välbehandlad hiv är riskfaktorer för att utveckla analcancer bland män som lever med hiv [7]. Vid välbehandlad hiv minskar risken för analcancer, men en ökad risk jämfört med hivnegativa personer kvarstår.
Det är värt att notera att förekomsten av HPV 16 analt hos män, oavsett riskgrupp, är relativt oförändrad över tid från cirka 25 års ålder, till skillnad från HPV16 cervikalt hos kvinnor där prevalensen sjunker betydligt efter 30 års ålder [8]. Orsaken till detta är okänd, men det bedöms bidra till sämre vaccineffekt hos män äldre än 26.
Den globala åldersstandardiserade incidensen av analcancer uppskattas till 1,7/100 000 personår, medan den i grupper med högst förekomst – MSM som lever med hiv och transkvinnor som lever med hiv – är så hög som >70/100 000 från 30 års ålder [6]. Denna siffra ökar till >100/100 000 från 45 års ålder i samma grupper. Globala siffror stämmer väl överens med svenska data, där män med hiv hade 74 gånger ökad risk för analcancer jämfört med hivnegativa män [7].
Orofaryngeal cancer
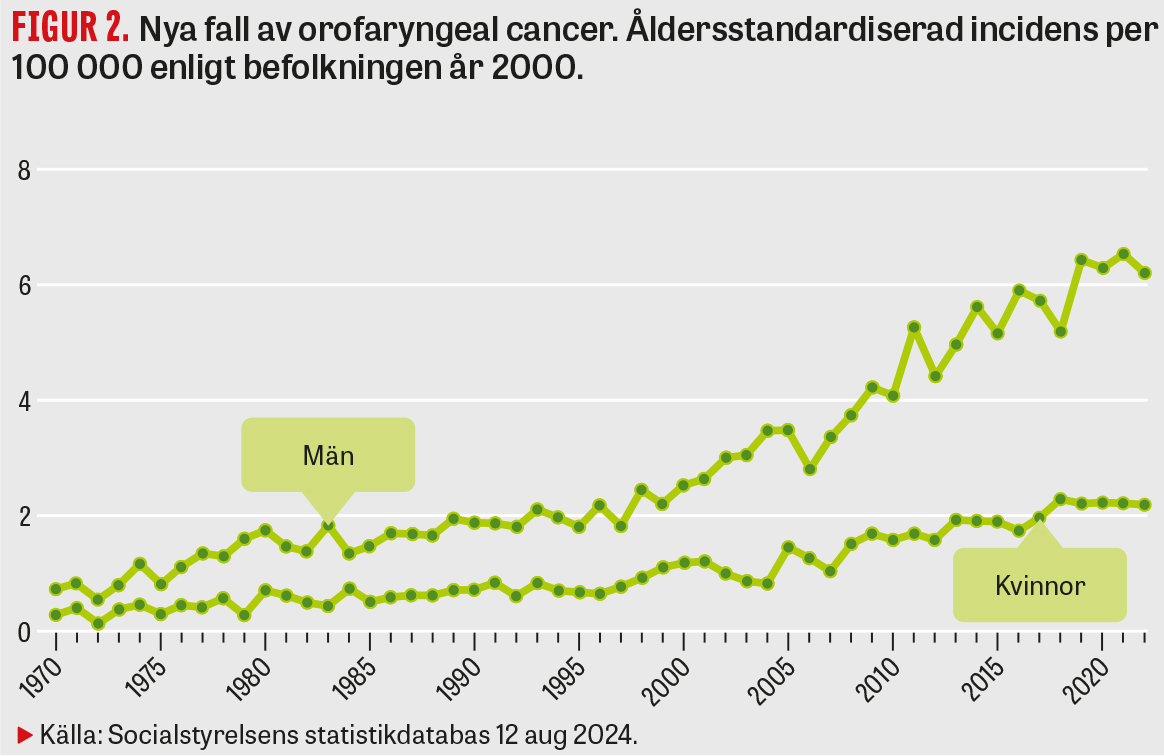
Drygt 70 procent av all orofaryngeal cancer drabbar män, och i Sverige är 70–80 procent HPV-relaterad. Globalt sett är andelen HPV-positiva fall ca 30 procent, men variationen är stor. Under år 2022 diagnostiserades i Sverige 497 män och 127 kvinnor med orofaryngeal cancer, vilket gav en åldersstandardiserad incidens på 6,2 respektive 2,2 per 100 000 invånare [5]. Av de HPV-positiva tumörerna är cirka 85–90 procent HPV 16-positiva, vilket är samstämmigt med data från övriga världen, i motsats till cervixcancer där man ser en större spridning av olika HPV-typer i olika regioner. Den näst vanligaste HPV-typen i orofarynx är HPV 33. Från 2008 till 2021 har antalet fall bland svenska män ökat med 93 procent, och i USA och Storbritannien har HPV-relaterad svalgcancer blivit vanligare än cervixcancer (Figur 2, Tabell 1) [9, 10]. Orofaryngeal cancer är en av de snabbast ökande formerna i Sverige, och man ser en procentuell ökning i paritet med kutana melanom.
De HPV-relaterade tumörerna man ser i orofarynx sitter främst i tonsill och tungbas. I övriga delar av orofarynx ser man inte samma HPV-förekomst, och inte heller en liknande incidensökning. I enlighet med data från USA ses även i Sverige en ökning av HPV-relaterad orofaryngeal cancer hos kvinnor, men ökningstakten är påtagligt högre hos män.
Riskfaktorer för HPV-positiv orofaryngeal cancer är främst det totala antalet sexpartner samt antalet personer man haft oralsex med [11].
Skillnaden mellan mäns och kvinnors incidensmönster kan möjligen förklaras av olika sårbarheter mellan könen, men också av olika sexuella beteenden. Man har även sett en skillnad i incidens mellan män som har sex med män och män som har sex med kvinnor samt en ökad förekomst av orofaryngeal cancer bland personer som lever med hiv [12].
In situ- eller dysplasiförändringar i anslutning till HPV-relaterad orofarynxcancer är ytterst sällsynta i jämförelse med fynden vid cervixcancer och analcancer. Detta gör det svårt med screeningverksamhet och behandling av dysplastiska förändringar.
Behandling av orofaryngeal cancer i de nordiska länderna består i första hand av strålning och i vissa fall kompletterande kirurgi och cytostatika. Ibland kan man överväga primär kirurgisk behandling. Femårsöverlevnaden vid HPV-relaterad orofaryngeal cancer är >75 procent. Behandlingarna för orofaryngeal cancer medför dock betydande morbiditet. Patienter drabbas ofta av långvariga biverkningar som omfattande muntorrhet, smakförlust, sväljsvårigheter och trismus. I allvarliga fall kan även osteoradionekros utvecklas. Dessa komplikationer leder till en markant försämring av patienternas livskvalitet efter behandlingen [13]. Mot bakgrund av detta blir primärprevention extra viktig.
Peniscancer
Peniscancer är en ovanlig cancerform som främst drabbar äldre män, med en medianålder vid diagnos på 60–80 år (Tabell 1). Den vanligaste histologiska formen är skivepitelcancer. Man bedömer att cirka 50 procent av fallen är relaterade till HPV-infektion, varav merparten HPV 16 (68 procent) [14]. Övriga riskfaktorer inkluderar rökning, inflammatoriska hudsjukdomar som lichen sclerosus samt immunsuppression. Personer med hiv har upp till 6 gånger ökad risk för peniscancer [15]. Behandlingen utgörs i första hand av kirurgi (89 procent), och 5-årsöverlevnaden är 82 procent. Även om invasiv cancer är ovanlig så är förekomsten av förstadierna, penil intraepitelial neoplasi, mycket besvärande för dem som drabbas, vilket även inkluderar yngre män. Incidensen av penil intraepitelial neoplasi har fördubblats i Sverige de senaste 20 åren (2010–2019) [16]. Även förstadierna orsakas främst av HPV 16 och behandlas i första hand kirurgiskt eller med topikal kräm [16].
Primärprevention av HPV-relaterad cancer hos män
HPV-vacciner är icke-levande vacciner som består av virusliknande partiklar skapade av virusets strukturella ytproteiner. Samtliga vacciner innehåller dessutom förstärkande ämnen i form av aluminiumhydroxidföreningar. Endast ett godkänt HPV-vaccin tillhandahålls för närvarande i Sverige: det 9-valenta (HPV 6, 11, 16,18, 31, 33, 45, 52 och 58).
Biverkningar är ovanliga, och en Cochrane-översikt från 2018 fann ingen ökad risk för allvarliga biverkningar hos dem som HPV-vaccinerats jämfört med kontrollgrupperna [17]. De vanligaste biverkningarna är lokala besvär vid injektionsstället, huvudvärk, illamående och feber. Dessa biverkningar är oftast lindriga till måttliga. Upp till 14 års ålder ges 2 doser och från 15 års ålder 3 doser.
Flickor erbjuds HPV-vaccination sedan år 2012 och pojkar sedan 2020. Detta innebär att alla folkbokförda barn, samt asylsökande och barn som vistas i landet utan nödvändiga tillstånd, ska erbjudas kostnadsfri vaccination mot HPV i årskurs 5. Täckningsgraden bland 12-åringar är god: under år 2022 erhöll 88 procent av flickorna och 83 procent av pojkarna 2 doser. Flickor födda 1993–1998 erbjöds catch up-vaccination från 2012. Sedan 2021 erbjuds kvinnor födda 1994–1999 vaccination inom ramen för projektet »Utrotning av livmoderhalscancer«. Pojkar och män födda 2008 och tidigare har inte erbjudits catch up-vaccination.
Vaccination mot HPV före sexuell debut ger det bästa skyddet mot HPV-infektion och senare cancerutveckling. En metaanalys inkluderande 14 studier och 10 763 individer visade att HPV-vaccin är mycket effektivt för att förebygga anal HPV-infektion och förstadier av analcancer hos personer som vaccinerats till och med 26 års ålder [18]. I samma metaanalys fann man ingen signifikant effekt av HPV-vaccin för att förebygga anal HPV-infektion och förstadier av analcancer när vaccinationen givits efter 26 års ålder. Noteras bör att studier på individer vaccinerade efter 26 års ålder nästan enbart inkluderade personer med hiv. Man fann heller ingen effekt av HPV-vaccin för att förebygga återfall efter behandling av anala kondylom eller förstadier av analcancer. Personer som lever med hiv har visat god immunitet efter vaccination, varför en effekt motsvarande den hos hivnegativa förväntas vid vaccination upp till 26 års ålder, även om effektdata saknas.
Effektdata saknas också för orofaryngeal cancer och peniscancer. Dessa indikationer saknas för närvarande i Fass, men allt talar för att HPV-vaccin skyddar även mot dessa HPV-relaterade cancerformer.
Kostnad för catch up-vaccination upp till 26 år
Folkhälsomyndighetens utredning tyder på att kostnaden för HPV-vaccination av ovaccinerade pojkar och män mellan 17 och 26 år skulle vara rimlig i förhållande till hälsovinsterna [4]. Den lägre åldersgränsen utgår ifrån att catch up-vaccinationen påbörjas under 2025, då pojkar födda 2008 fyller 17 år. Beräkningarna utgår från att alla erbjuds catch up-vaccination och att man når en vaccinationstäckning på 60 procent i åldersgruppen 17–19 år och 40 procent bland män 20–26 år. En separat analys av MSM gav samma resultat. Utredningen innehåller inte några särskilda beräkningar för transpersoner eller personer med hiv. Eftersom risken för att utveckla HPV-orsakad cancer är högre för personer med hiv än för MSM utan hiv, och bedöms vara högre bland transpersoner än cis-personer, anses vaccination även av dessa grupper till och med 26 års ålder vara kostnadseffektiv. Vid 26 års ålder är många i dessa grupper redan infekterade med flera HPV-typer, vilket minskar effekten av vaccination. Folkhälsomyndigheten undersökte kostnadseffektiviteten av catch up-vaccination i grupperna 27–30 år och i gruppen MSM 27–45 år och fann inte stöd för att vaccination av dessa grupper skulle vara kostnadseffektiv. Kostnaden för catch up-vaccination av alla ovaccinerade pojkar och män upp till 26 års ålder med vaccinationsstart under 2025 beräknas bli ca 720 miljoner kronor med det 2- eller 4-valenta vaccinet (baserat på tidigare listpriser) och omkring 1 170 miljoner kronor med det 9-valenta vaccinet (baserat på dagens listpris). Inkluderat i denna summa är 77 miljoner kronor för administrering av vaccinet [4]. Vid gemensam nationell upphandling bör vaccinationskostnaderna kunna reduceras påtagligt.
Hur skyddas kvinnorna av att männen vaccineras?
I dag har kvinnor upp till 24 år så hög vaccinationstäckning att infektioner med högrisk-HPV i princip försvunnit [3]. Catch up-vaccination av kvinnor upp till 29 år pågår, men med svårigheter att nå hela gruppen [19]. Vaccination av män leder till minskad mängd cirkulerande HPV i befolkningen [20]. Minskad HPV-överföring från man till kvinna minskar bördan av kondylom och förstadier till livmoderhalscancer och kommer även att minska förekomsten av cervixcancer, analcancer och orofaryngeal cancer bland ovaccinerade kvinnor. Att inkludera pojkar, unga män och riskgrupper i kostnadsfri catch up-vaccination skulle stärka flockimmuniteten och ge positiva effekter även för ovaccinerade flickor och kvinnor samt påskynda utrotningen av livmoderhalscancer.
Sekundärprevention av HPV-relaterad cancer hos män
Screening för att upptäcka analcancer och dess förstadier erbjuder vissa svårigheter. Analt HPV-test och cytologi har hög sensitivitet, men låg specificitet. Högresolutionsanoskopi används för att upptäcka och behandla förstadier till cancer, men kapaciteten i Sverige är begränsad. En ny metod med flexibel endoskopi har visat lovande resultat [21].
Anchor-studien, en amerikansk studie som inkluderade män över 35 år med hiv, visade för första gången att behandling av förstadier till analcancer är effektiv: risken för analcancer minskade med 60 procent i gruppen som fick behandling för höggradig intraepitelial skivepitellesion, jämfört med kontrollgruppen som observerades utan intervention [22]. Som en följd därav har International Anal Neoplasia Society publicerat nya riktlinjer för analcancerscreening med följande rekommendationer [23]:
- MSM med hiv och transkvinnor med hiv rekommenderas årlig screening från 35 års ålder.
- Hivnegativa MSM, hivnegativa transkvinnor, män med hiv som har sex med kvinnor och kvinnor med hiv rekommenderas screening från 45 års ålder.
- Organtransplanterade individer rekommenderas screening med början 10 år efter transplantation.
- Kvinnor med (förstadier till) vulvacancer rekommenderas screening med start 1 år efter diagnosen.
Tre modeller för analcancerscreening föreslås också: 1) enbart cytologi, 2) enbart högrisk-HPV-test, 3) cytologi + högrisk-HPV-test. Avvikande provsvar ska leda till högresolutionsanoskopi och eventuell behandling.
En svensk studie av MSM med hiv visade att analcancerscreening med flexibel endoskopi tolererades väl och påvisade en hög incidens av höggradig intraepitelial skivepitellesion [24].
För närvarande finns inga vedertagna screeningmetoder för peniscancer eller orofaryngeal cancer. Forskning pågår för att finna nya biomarkörer för screening av HPV-relaterad cancer.
Konklusion
HPV-relaterad cancer hos män utgör ett växande folkhälsoproblem, särskilt med ökande incidens av analcancer och orofaryngeal cancer. Riskgrupper som MSM, transpersoner och personer som lever med hiv är särskilt utsatta. HPV-vaccination har visat sig vara ett effektivt verktyg för att minska HPV-infektioner och HPV-relaterad cancer [18] och bör helst ges före sexualdebut för bästa effekt. Folkhälsomyndigheten bedömer att catch up-vaccination av ovaccinerade män upp till 26 års ålder är kostnadseffektiv. Detta skyddar män direkt och gynnar kvinnor genom minskad HPV-överföring och stärkt flockimmunitet. Nya riktlinjer för analcancerscreening kan bidra till tidigare upptäckt och behandling. En heltäckande nationell strategi krävs för att minska HPV-relaterad cancer bland både män och kvinnor. Sammantaget krävs en omfattande strategi som kombinerar ökad vaccinationstäckning, riktade insatser mot högriskgrupper, förbättrad screening och fortsatt forskning för att effektivt minska bördan av HPV-relaterad cancer hos män och i förlängningen hela befolkningen.
Läs även: Medicinsk kommentar Är vi förhoppningsvis på väg att utrota HPV-relaterad cancer?
Lalle Hammarstedt Nordenvall är ordförande i Svenskt kvalitetsregister för huvud- och halscancer.
Potentiella bindningar eller jävsförhållanden: Christina Carlander har erhållit arvode betalt till Karolinska universitetssjukhuset från Gilead Sciences, MSD och GSK Viiv för uppdrag som föreläsare, moderator och i rådgivande kommitté samt forskningsanslag från Gilead Sciences Nordic Fellowship. Christer Borgfeldt har erhållit arvode betalt till forskningskonto i Region Skåne från Hologic Inc, MSD och Avia Pharma AB för uppdrag som föreläsare samt forskningsanslag från Hologic Inc och Vinnova. Lalle Hammarstedt Nordenvall är »scientific review committee member« för MSD. Magnus Gisslén har erhållit arvode från Amgen, Astra Zeneca, Biogen, Bristol Myers Squibb, Gilead Sciences, GSK Viiv, Janssen Cilag, MSD, Novocure, Novo Nordic, Pfizer och Sanofi för uppdrag som föreläsare, moderator, i rådgivande kommitté och i DSMB (oberoende säkerhetskommitté) samt forskningsanslag från Gilead Sciences; hans uppdrag är avslutade, och det finns inga pågående uppdrag.